Химические и физические свойства кальция, его взаимодействие с водой
Почему металл хранят в герметичной банке
Твитнуть
Отправить
[Deposit Photos]Кальций располагается в четвертом большом периоде, второй группе, главной подгруппе, порядковый номер элемента — 20. Согласно периодической таблице Менделеева, атомный вес кальция — 40,08. Формула высшего оксида — СаО. Кальций имеет латинское название calcium, поэтому символ атома элемента — Са.
Характеристика кальция как простого вещества
При обычных условиях кальций — это металл серебристо-белого цвета. Имея высокую химическую активность, элемент способен образовывать множество соединений разных классов. Элемент представляет ценность для технических и промышленных химических синтезов. Металл широко распространен в земной коре: его доля составляет около 1,5 %. Кальций относится к группе щелочноземельных металлов: при растворении в воде он дает щелочи, но в природе встречается в виде множественных минералов и солей. Морская вода содержит кальций в больших концентрациях (400 мг/л).
Кальций относится к группе щелочноземельных металлов: при растворении в воде он дает щелочи, но в природе встречается в виде множественных минералов и солей. Морская вода содержит кальций в больших концентрациях (400 мг/л).
Характеристики кальция зависят от строения его кристаллической решетки. У этого элемента она бывает двух типов: кубическая гранецентрическая и объемноцентрическая. Тип связи в молекуле кальция — металлический.
Природные источники кальция:
- апатиты;
- алебастр;
- гипс;
- кальцит;
- флюорит;
- доломит.
Физические свойства кальция и способы получения металла
В обычных условиях кальций находится в твердом агрегатном состоянии. Металл плавится при 842 °С. Кальций является хорошим электро- и теплопроводником. При нагревании он переходит сначала в жидкое, а затем в парообразное состояние и теряет металлические свойства. Металл является очень мягким и режется ножом. Кипит при 1484 °С.
Металл является очень мягким и режется ножом. Кипит при 1484 °С.
Под давлением кальций теряет металлические свойства и способность к электропроводимости. Но затем металлические свойства восстанавливаются и проявляются свойства сверхпроводника, в несколько раз превышающего по своим показателям остальные элементы.
Кальций долго не удавалось получить без примесей: из-за высокой химической активности этот элемент не встречается в природе в чистом виде. Элемент был открыт в начале XIX века. Кальций как металл впервые синтезировал британский химик Гемфри Дэви. Ученый обнаружил особенности взаимодействия расплавов твердых минералов и солей с электрическим током. В наши дни электролиз солей кальция (смеси хлоридов кальция и калия, смеси фторида и хлорида кальция) остается самым актуальным способом получения металла. Кальций также извлекают из его оксида с помощью алюминотермии — распространенного в металлургии метода.
Химические свойства кальция
Кальций — активный металл, вступающий во многие взаимодействия. При нормальных условиях он легко реагирует, образуя соответствующие бинарные соединения: с кислородом, галогенами. Нажмите здесь, чтобы узнать больше о соединениях кальция. При нагревании кальций реагирует с азотом, водородом, углеродом, кремнием, бором, фосфором, серой и другими веществами. На открытом воздухе мгновенно взаимодействует с кислородом и углекислым газом, поэтому покрывается серым налетом.
При нормальных условиях он легко реагирует, образуя соответствующие бинарные соединения: с кислородом, галогенами. Нажмите здесь, чтобы узнать больше о соединениях кальция. При нагревании кальций реагирует с азотом, водородом, углеродом, кремнием, бором, фосфором, серой и другими веществами. На открытом воздухе мгновенно взаимодействует с кислородом и углекислым газом, поэтому покрывается серым налетом.
Бурно реагирует с кислотами, при этом иногда воспламеняется. В солях кальций проявляет интересные свойства. Например, пещерные сталактиты и сталагмиты — это карбонат кальция, постепенно образовавшийся из воды, углекислого газа и гидрокарбоната в итоге процессов внутри подземных вод.
Из-за высокой активности в обычном состоянии кальций хранится в лабораториях в темной герметичной стеклянной посуде под слоем парафина или керосина. Качественная реакция на ион кальция — окрашивание пламени в насыщенный кирпично-красный цвет.
Кальций окрашивает пламя в красный цвет [Wikimedia]
Реакция воды с кальцием
Кальций хранят в банках под слоем защитной жидкости. Чтобы провести опыт, демонстрирующий, как происходит реакция воды и кальция, нельзя просто достать металл и отрезать от него нужный кусочек. Металлический кальций в лабораторных условиях проще использовать в виде стружки.
Если металлической стружки нет, а в банке есть только большие куски кальция, потребуются пассатижи или молоток. Готовый кусочек кальция нужного размера помещают в колбу или стакан с водой. Кальциевую стружку кладут в посуду в марлевом мешочке.
Кальций опускается на дно, и начинается выделение водорода (сначала в месте, где находится свежий излом металла). Постепенно с поверхности кальция выделяется газ. Процесс напоминает бурное кипение, одновременно образовывается осадок гидроксида кальция (гашёная известь).
Гашение извести [Flickr]Кусок кальция всплывает, подхваченный пузырьками водорода. Примерно через 30 секунд кальций растворяется, а вода из-за образования взвеси гидроксида становится мутно-белой. Если реакцию проводить не в стакане, а в пробирке, можно наблюдать выделение тепла: пробирка быстро становится горячей. Реакция кальция с водой не заканчивается эффектным взрывом, но взаимодействие двух веществ протекает бурно и выглядит зрелищно. Опыт безопасен.
Примерно через 30 секунд кальций растворяется, а вода из-за образования взвеси гидроксида становится мутно-белой. Если реакцию проводить не в стакане, а в пробирке, можно наблюдать выделение тепла: пробирка быстро становится горячей. Реакция кальция с водой не заканчивается эффектным взрывом, но взаимодействие двух веществ протекает бурно и выглядит зрелищно. Опыт безопасен.
Если мешочек с оставшимся кальцием вынуть из воды и подержать на воздухе, то через некоторое время в результате продолжающейся реакции наступит сильное разогревание и оставшаяся в марле вода закипит. Если часть помутневшего раствора отфильтровать через воронку в стакан, то при пропускании через раствор оксида углерода CO₂ получится осадок. Для этого не нужен углекислый газ — можно продувать выдыхаемый воздух в раствор через стеклянную трубочку.
Твитнуть
Отправить
Больше статей о химии:
- Эксперимент «Ослепительное пламя» Горение магния в воде
- Эксперимент «Химический маятник» Реакция Белоусова-Жаботинского
Делайте эксперименты дома!
Так какого же он цвета?
Узнать больше
Попробовать
Кальций Магний Цинк и витамины D3, K2
Кальций — макроэлемент, который в организме человека принимает непосредственное участие в метаболиче- ских процессах и формировании тканей и используется буквально каждой клеткой человеческого организма. При пониженном уровне кальция происходит его извлечение из резервов, которыми являются кости и зубная эмаль. .
При пониженном уровне кальция происходит его извлечение из резервов, которыми являются кости и зубная эмаль. .
Признаком такого дефицита являются проблемы с зубами, склонность к частым переломам. Но если непосредственное участие в формировании костей и зубов кальция общеизвестно, то далеко не все знают, что этот макроэлемент влияет на работу сердечно-сосудистой системы, питает нервные ткани, понижает уровень холестерина, нормализует артериальное давление и т. д.
Важно учитывать, что понижение уровня кальция в крови может стать следствием употребления пищи с низким содержанием магния, фосфора и витамина D3. Именно эти компоненты оказывают непосредственное влияние на про- цесс кальциевого усвоения. .
Магний — микроэлемент, который обеспечивает нормальное функционирова- ние нервной и мышечной систем, а также входит в состав многих ферментов. Магний участвует в энергетическом обмене, проведении нервных импульсов, сокращении мышечных волокон, создании костного каркаса и производстве нуклеиновых кислот. Этот микроэлемент накапливается в костной и мышечной ткани, эритроцитах и клетках печени. Магний помогает организму усваивать витамины и минералы, такие как кальций, фосфор, натрий, калий и витамин D3.
Этот микроэлемент накапливается в костной и мышечной ткани, эритроцитах и клетках печени. Магний помогает организму усваивать витамины и минералы, такие как кальций, фосфор, натрий, калий и витамин D3.
Цинк входит в состав более 200 ферментов, которые участвуют в различных обменных реакциях, включая синтез и распад углеводов, белков, жиров и нук- леиновых кислот — основного генетического материала. Он играет важную роль в формировании скелета, необходим для функционирования иммунной системы, обладает антивирусными и антитоксическими свойствами, участвует в борьбе с инфекционными болезнями и раком.
Витамин D3 также отвечает за усвоение кальция в организме. В комбинации, они помогают предотвратить появление и уменьшить риск перелома костей.
Витамин D3 имеет положительное влияние на состояние мышц, а также защищает от таких болезней как рахит и остеомаляция. Одна из наиболее важных функций витамина D3 состоит в стабилизации уровня кальция в организме.
Именно поэтому, максимальное усвоение кальция происходит только тогда, когда в организме находится достаточное количество витамина D3.
Витамин К2 направляет кальций в костную ткань, тем самым поддерживая здоровье костей. Также он нужен организму для заживления ран (обеспечивая свертываемость крови). Витамин D3 и К2 работают вместе для укрепления кос- тей и их правильного развития.
Авиценна Кальций Магний Цинк D3 и К2 — это сбалансированная комбинация необходимых витаминов и минералов, обеспечивающая их совместное пра- вильное взаимодействие.
кальций | Определение, свойства и соединения
кальций
Посмотреть все СМИ
- Ключевые люди:
- сэр Хамфри Дэви Иоганн Вольфганг Доберейнер
- Похожие темы:
- химический элемент щелочноземельный металл дефицит кальция
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
кальций (Ca) , химический элемент, один из щелочноземельных металлов группы 2 (IIa) периодической таблицы. Это самый распространенный металлический элемент в организме человека и пятый по распространенности элемент в земной коре.
Это самый распространенный металлический элемент в организме человека и пятый по распространенности элемент в земной коре.
| атомный номер | 20 | ||
|---|---|---|---|
| атомный вес | 40,078 90337 | точка плавления0035 | 842 °C (1,548 °F) |
| 1,484 °C (2,703 °F) | |||
| specific gravity | 1.55 (20 °C, or 68 °F) | ||
| oxidation state | +2 | ||
| electron configuration | 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 с 2 |
Кальций не встречается в природе в свободном состоянии, но соединения этого элемента широко распространены. Одно соединение кальция, известь (оксид кальция, CaO), широко использовалось древними. Сам серебристый, довольно мягкий, легкий металл был впервые выделен (1808 г.) сэром Хамфри Дэви после дистилляции ртути из амальгамы, образованной путем электролиза смеси извести и оксида ртути. Название элемента произошло от латинского слова «известь», calx 9.0074 .
Одно соединение кальция, известь (оксид кальция, CaO), широко использовалось древними. Сам серебристый, довольно мягкий, легкий металл был впервые выделен (1808 г.) сэром Хамфри Дэви после дистилляции ртути из амальгамы, образованной путем электролиза смеси извести и оксида ртути. Название элемента произошло от латинского слова «известь», calx 9.0074 .
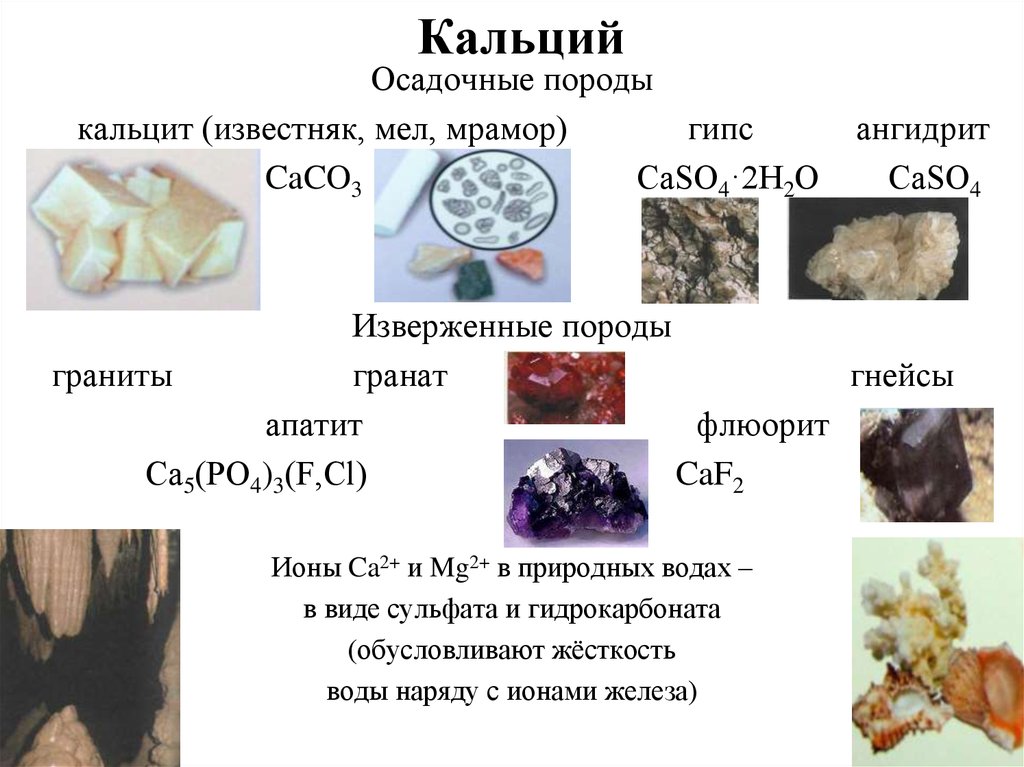
Кальций составляет 3,64 процента земной коры и 8 процентов лунной коры, а его космическое содержание оценивается в 4,9 × 10 4 атомов (по шкале, где содержание кремния составляет 10 6 атомов). В виде кальцита (карбоната кальция) он встречается на Земле в известняке, меле, мраморе, доломите, яичной скорлупе, жемчуге, кораллах, сталактитах, сталагмитах и панцирях многих морских животных. Отложения карбоната кальция растворяются в воде, содержащей углекислый газ, с образованием бикарбоната кальция Ca(HCO 3 ) 2 . Этот процесс часто приводит к образованию пещер и может привести к отложению известняка в виде сталактитов и сталагмитов. В виде гидроксилфосфата кальция он является основным неорганическим компонентом зубов и костей и встречается в виде минерального апатита. Как фторид кальция, он встречается в виде флюорита или плавикового шпата. А в виде сульфата кальция он встречается в виде ангидрита. Кальций содержится во многих других минералах, таких как арагонит (разновидность карбоната кальция) и гипс (другая форма сульфата кальция), а также во многих полевых шпатах и цеолитах. Встречается также в большом количестве силикатов и алюмосиликатов, в солевых отложениях, в природных водах, в том числе морских.
В виде гидроксилфосфата кальция он является основным неорганическим компонентом зубов и костей и встречается в виде минерального апатита. Как фторид кальция, он встречается в виде флюорита или плавикового шпата. А в виде сульфата кальция он встречается в виде ангидрита. Кальций содержится во многих других минералах, таких как арагонит (разновидность карбоната кальция) и гипс (другая форма сульфата кальция), а также во многих полевых шпатах и цеолитах. Встречается также в большом количестве силикатов и алюмосиликатов, в солевых отложениях, в природных водах, в том числе морских.
Чистый металлический кальций, который раньше производился электролизом безводного хлорида кальция, теперь производится в промышленных масштабах путем нагревания извести с алюминием. Металл медленно реагирует с кислородом, водяным паром и азотом воздуха с образованием желтого покрытия из оксида, гидроксида и нитрида. Он сгорает на воздухе или в чистом кислороде с образованием оксида и быстро реагирует с теплой водой (и медленнее с холодной водой) с образованием газообразного водорода и гидроксида кальция.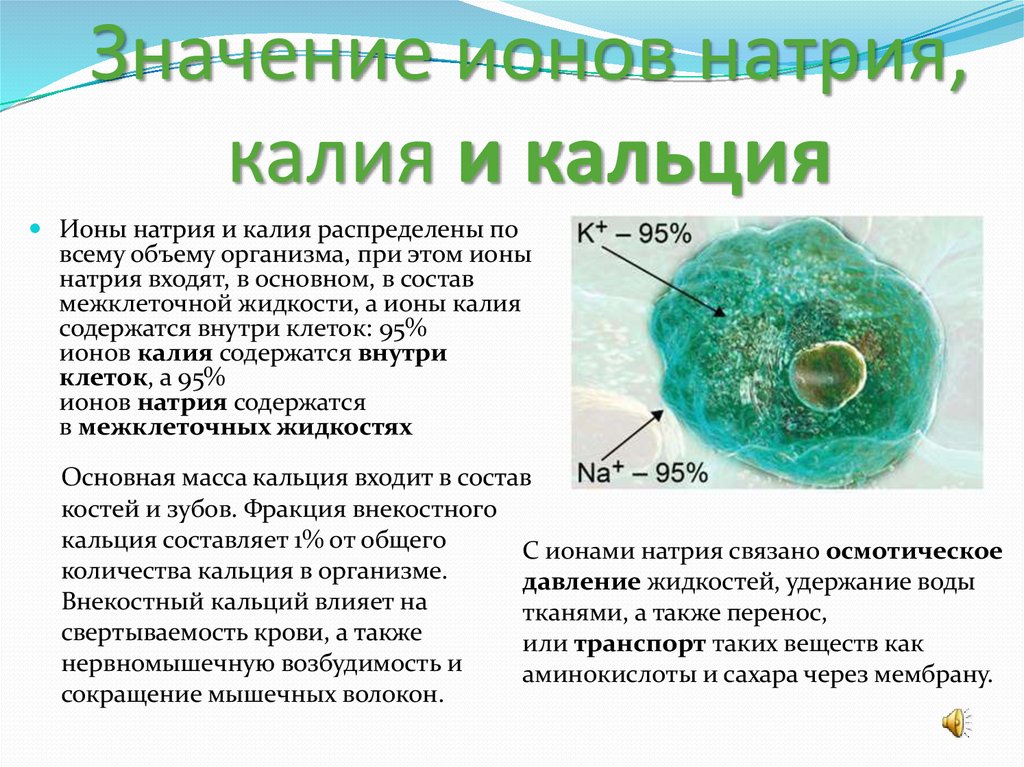
Britannica Викторина
118 Названия и символы периодической таблицы Викторина
Элементарная викторина по фундаментальным вопросам.
Сам металл используется в качестве легирующего агента для алюминия, меди, свинца, магния и других недрагоценных металлов; как раскислитель для некоторых жаропрочных сплавов; и как газопоглотитель в электронных лампах. Небольшие проценты кальция используются во многих сплавах специального назначения. Легированный свинцом (0,04% кальция), например, используется в качестве оболочек для телефонных кабелей и в качестве сеток для аккумуляторных батарей стационарного типа.
Встречающийся в природе кальций состоит из смеси шести изотопов: кальция-40 (96,94 процента), кальция-44 (2,09 процента), кальция-42 (0,65 процента) и, в меньших пропорциях, кальция-48, кальция-43, и кальций-46. Кальций-48 подвергается двойному бета-распаду с периодом полураспада примерно 4 × 10 19 лет, поэтому он стабилен для всех практических целей. Он особенно богат нейтронами и используется в синтезе новых тяжелых ядер в ускорителях частиц. Радиоактивный изотоп кальция-41 встречается на Земле в следовых количествах в результате естественной бомбардировки кальция-40 нейтронами космических лучей.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Кальций необходим как для растений, так и для животных и широко используется в качестве преобразователя сигналов, ферментного кофактора и структурного элемента (например, клеточных мембран, костей и зубов). Большое количество живых организмов концентрирует кальций в своих панцирях или скелетах, а у высших животных кальций является наиболее распространенным неорганическим элементом. Многие важные месторождения карбонатов и фосфатов обязаны своим происхождением живым организмам.
Большое количество живых организмов концентрирует кальций в своих панцирях или скелетах, а у высших животных кальций является наиболее распространенным неорганическим элементом. Многие важные месторождения карбонатов и фосфатов обязаны своим происхождением живым организмам.
Человеческое тело состоит из 2 процентов кальция. Основными источниками кальция в рационе человека являются молоко, молочные продукты, рыба и зеленые листовые овощи. Заболевание костей рахит возникает, когда недостаток витамина D ухудшает всасывание кальция из желудочно-кишечного тракта во внеклеточную жидкость. Заболевание особенно поражает младенцев и детей.
Это элементарно — элемент Кальций
Предыдущий элемент
(калий)
Периодическая таблица элементов
Следующий элемент
(скандий)
Таблица элементов
Элемент кальций
[Click for Isotope Data]
Кальций
20CACALCIUM40.078Атомный номер: 20
. °F)
°F)
Температура кипения: 1757 K (1484°C или 2703°F)
Плотность: 1,54 грамма на кубический сантиметр
Фаза при комнатной температуре: Твердое вещество
Классификация элемента: Металл
Номер периода: 4
Номер группы: 2
Название группы: Щелочноземельный металл
Что в названии? От латинского слова известь, calx .
Что сказать? Кальций произносится как KAL-see-em .
История и использование:
Хотя кальций является пятым наиболее распространенным элементом в земной коре, он никогда не встречается в природе в свободном виде, так как легко образует соединения, реагируя с кислородом и водой. Металлический кальций был впервые выделен сэром Хамфри Дэви в 1808 году путем электролиза смеси извести (CaO) и оксида ртути (HgO). Сегодня металлический кальций получают путем замещения атомов кальция в извести атомами алюминия в горячих сосудах низкого давления. Около 4,2% земной коры состоит из кальция.
Из-за его высокой реакционной способности с обычными материалами потребность в металлическом кальции очень мала. Он используется в некоторых химических процессах для очистки тория, урана и циркония. Кальций также используется для удаления кислорода, серы и углерода из некоторых сплавов. Кальций может быть легирован алюминием, бериллием, медью, свинцом и магнием. Кальций также используется в вакуумных трубках в качестве геттера, материала, который соединяется с газовыми примесями и удаляет их из вакуумных трубок.
Карбонат кальция (CaCO 3 ) — одно из распространенных соединений кальция. Его нагревают с образованием негашеной извести (CaO), которую затем добавляют в воду (H 2 O). Это образует другой материал, известный как гашеная известь (Ca(OH) 2 ), который является недорогим основным материалом, используемым в химической промышленности. Мел, мрамор и известняк — все это формы карбоната кальция. Карбонат кальция используется, среди прочего, для изготовления белой краски, чистящего порошка, зубной пасты и желудочных антацидов. Другие распространенные соединения кальция включают: сульфат кальция (CaSO 4 ), также известный как гипс, который используется для изготовления сухих стен и штукатурки Парижа, нитрат кальция (Ca (NO 3 ) 2 ), природное удобрение и фосфат кальция (Ca 3 ( PO 4 ) 2 ), основной материал, содержащийся в костях и зубах.
Другие распространенные соединения кальция включают: сульфат кальция (CaSO 4 ), также известный как гипс, который используется для изготовления сухих стен и штукатурки Парижа, нитрат кальция (Ca (NO 3 ) 2 ), природное удобрение и фосфат кальция (Ca 3 ( PO 4 ) 2 ), основной материал, содержащийся в костях и зубах.
Расчетное содержание в земной коре: 4,15×10 4 миллиграмм на килограмм
Расчетное количество в океане: 4,12×10 2 миллиграмм на литр
Количество стабильных изотопов: 3 (Просмотреть все изотопы) 9o0003
Ionization Energy: 6.113 eV
Oxidation States: +2
Electron Shell Configuration: | 1s 2 |
2s 2 2p 6 | |
3S 2 3P 6 | |
4S 2 |
Citation и LIGING.
