от ранней стадии до последней
Что такое стадирование меланомы?
Определение стадии опухоли называется стадирование меланомы. Заключение основано на размере, толщине, скорости митоза, как часто и сильно изъязвляется новообразование, поразило ли оно лимфоузлы или другие органы.
Стадию меланомы определяют по результатам комплексного обследования:
- медицинского осмотра у дерматолога-онколога;
- с помощью дерматоскопа;
- гистологии;
- биохимии крови;
- диагностических методов (КТ – компьютерная томография, МРТ – магнитно-резонансная томография, УЗИ – ультразвуковое исследование, рентгенография).
Стадирование злокачественной опухоли очень важно, поскольку дает врачам возможность подобрать максимально эффективное лечение для разной степени меланомы.
Методы стадирования меланомы
Фактически существует два основных метода для определения стадии развития меланомы: клинический, в основе которого осмотр специалиста и результаты биопсии (морфологическое исследование образца клеток), и гистологический (микроскопический метод исследования тканей, органов и систем организма, включающий биопсию и операционный материал).
| Стадия меланомы | Характеристика распространения меланомы |
| Стадия 0 | Tis, N0, M0:Меланома на месте, означает, что она находится в эпидермисе, но не распространена на дерму (нижний слой). |
| Стадия IA | T1a, N0, M0: Меланома тоньше 1 мм. Она не изъязвлена и скорости митоза меньше 1/мм 2. Не была обнаружена в лимфатических узлах или дистальных органах. |
| Стадия IB | T1b или T2a, N0, M0: Меланома тоньше 1 мм и изъязвлена, или скорость ее митоза меньше 1/мм2, или ее толщина между 1,01 и 2,0 мм и она не изъязвлена. Не была обнаружена в лимфатических узлах или дистальных органах. |
| Стадия IIA | T2b или T3a, N0, M0: Толщина меланомы между 1,01 и 2,0 мм и она изъязвлена, или толщина меланомы между 2,01 и 4,0 мм и она не изъязвлена. Не была обнаружена в лимфатических узлах или дистальных органах. Не была обнаружена в лимфатических узлах или дистальных органах. |
| Стадия IIB | T3b или T4a, N0, M0: Толщина меланомы между 2,01 и 4,0 мм и она изъязвлена, или толщина меланомы больше 4,0 мм и она не изъязвлена. Не была обнаружена в лимфатических узлах или дистальных органах. |
| Стадия IIC | T4b, N0, M0: Меланома толще 4 мм с изъязвлениями. Не была обнаружена в лимфатических узлах или дистальных органах. |
| Стадия IIIA | T1a до T4a, N1a или N2a, M0: Меланома может быть любой толщины, но не изъязвлена. Меланома распространена на 1-3 лимфатического узла рядом с пораженным участком кожи, но узлы не увеличены и меланома обнаруживается только при просмотре под микроскопом. Отдаленное распространение отсутствует. |
| Стадия IIIB | Применяется одно из следующего: T1b до T4b, N1a или N2a, M0: Меланома может быть любой толщины, и изъязвлена. Меланома распространена на 1-3 лимфатического узла рядом с пораженным участком кожи, но узлы не увеличены и меланома обнаруживается только при просмотре под микроскопом. Отдаленное распространение отсутствует. T1a до T4a, N1b или N2b, M0: Меланома может быть любой толщины, но не изъязвлена. Распространена на 1-3 лимфатических узла рядом с пораженным участком кожи. Узлы увеличены из-за меланомы. Отдаленное распространение отсутствует. Меланома распространена на 1-3 лимфатического узла рядом с пораженным участком кожи, но узлы не увеличены и меланома обнаруживается только при просмотре под микроскопом. Отдаленное распространение отсутствует. T1a до T4a, N1b или N2b, M0: Меланома может быть любой толщины, но не изъязвлена. Распространена на 1-3 лимфатических узла рядом с пораженным участком кожи. Узлы увеличены из-за меланомы. Отдаленное распространение отсутствует.T1a до T4a, N2c, M0: Меланома может быть любой толщины, но не изъязвлена. Распространена на небольшие участки близлежащей кожи или лимфатические каналы вокруг исходной опухоли, но узлы не содержат меланомы. Отдаленное распространение отсутствует. |
| Стадия IIIС | Применяется одно из следующего: T1b до T4b, N1b или N2b, M0: Меланома может быть любой толщины, и изъязвлена. Распространена на 1-3 лимфатических узла рядом с пораженным участком кожи. Узлы увеличены из-за меланомы. Отдаленное распространение отсутствует. T1b до T4b, N2c, M0: Меланома может быть любой толщины, и изъязвлена. Распространена на небольшие участки близлежащей кожи или лимфатические каналы вокруг исходной опухоли, но узлы не содержат меланомы. Отдаленное распространение отсутствует. Любые T, N3, M0: Меланома может быть любой толщины и может быть изъязвлена или нет. Меланома распространена на 4 или более близлежащих лимфатических узла, которые скучены вместе, или она распространена на близлежащую кожу или лимфатические каналы вокруг исходной опухоли и на близлежащие лимфатические узлы. Узлы увеличены из-за меланомы. Отдаленное распространение отсутствует. |
| Стадия IV | Любые T, любые N, M1(a, b, или c): При 4 стадии меланома распространена за пределы первоначальной площади кожи и близлежащие лимфатические узлы к другим органам, таким как легкие, печень или мозг, или в отдаленные участки кожи, подкожной ткани, или отдаленные лимфатические узлы. На данной стадии не рассматриваются ни распространение на близлежащие лимфатические узлы, ни толщина, но меланома, как правило, толстая и также распространена на лимфатические узлы. |
Классификация меланомы
В современной онкологии используется несколько классификаций для определения стадии рака кожи – меланомы (по Кларку, по А. Бреслоу, митотический индекс). Наиболее часто обращаются к системе TNM, которую разработало AJCC (Американское общество по изучению рака). В названии TNM заложены ключевые факторы для определения степени рака кожи: Tumor – опухоль, Lymph Node – лимфатический узел, Metastasis – метастазы.
- Категория Т
- обозначает толщину опухоли (измеряют по системе Бреслоу). Кроме того, учитывают скорость митоза (дает возможность прогнозировать, насколько быстро рак распространится на другие ткани и органы), есть или отсутствуют изъязвления (повреждения, разрывы верхнего слоя кожи поверх опухоли). В описании истории болезни можно встретить, к примеру, такие значения категории Т: Т1а (характерно для рака кожи на первой стадии) или Т4b (такой индекс чаще встречается на последней стадии рака кожи).

- Категория N
- указывает, есть ли опухоль в лимфоузлах, которые рак поражает в первую очередь. Эту маркировку используют на основе результатов биопсии. Для ранней стадии меланомы характерно обозначение N0 (опухоль не метастазировала на регионарные лимфоузлы), для поздних стадий – N3 (в близлежащих лимфоузлах есть 2–3 метастазы), N2b (патологическое увеличение лимфатических узлов видно без микроскопа).
- Категория М
- указывает, распространилась ли меланома на другие органы и какие именно, а также, насколько изменился уровень фермента ЛДГ (лактатдегидрогеназа, принимает участие в гликолизе). На ранней стадии рака кожи опухоль, как правило, не метастазирует.
Степени меланомы
| Стадии меланомы | Характеристика стадии |
|---|---|
| 0 | Меланома пока только в эпидермисе (in situ). Неинвазивна, не распространяется в глубокие слои и другие части тела. |
| I (бывает А и В) | На ранней стадии толщина злокачественного новообразования – до 1 мм. Она не кровоточит, нет язв и шелушений. Низкая скорость клеточного деления. Хирургическое удаление ракового образования – обычно это все, что требуется на первой стадии меланомы. Метастаз в лимфоузлах и отдаленных органах не наблюдается. |
| II (бывает A, В, С) | Опухоль прорастает вглубь, ее толщина увеличивается до 2,0 мм (4,0 мм), поверхность злокачественного образования гипертрофирована, шелушится, покрыта язвами, иногда кровоточит. На этой стадии раковые клетки еще не поражают лимфатические узлы и отдаленные органы. |
| III (бывает А, В, С) | Раковые клетки достигают лимфатических узлов. Они увеличиваются или остаются прежними. Опухоль становится толще, прорастает вглубь ткани. Изъязвления могут быть или нет. Для борьбы с болезнью используют хирургические методы, лучевую и химиотерапию. |
| IV | Последняя стадия меланомы, когда опухоль метастазировала на внутренние органы (легкие, печень или мозг), отдельные участки кожи или отдаленные лимфоузлы.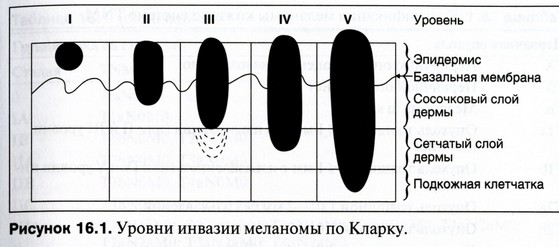 Терапия на этом этапе комплексная и длительная, справиться с опухолью можно хирургически (удаляют и кожные очаги, если возможно – метастазы из внутренних органов). Терапия на этом этапе комплексная и длительная, справиться с опухолью можно хирургически (удаляют и кожные очаги, если возможно – метастазы из внутренних органов). |
Методы лечения
Лечение меланомы зависит от стадии опухоли. Ранние стадии рака кожи хорошо поддаются терапии, поскольку поражена только кожа, и опухоль не проросла в глубокие слои, не задела лимфоузлы и другие органы. На второй и третьей стадиях также проводят хирургическое иссечение плюс иммунную терапию. Меланома на 4 стадии распространяется на внутренние органы и костную систему, терапия заболевания – комплексная (хирургическое вмешательство, прием противоопухолевых препаратов, лучевая терапия).
Существует общепринятый протокол лечения меланомы кожи, которого придерживаются в разных странах:
Стадия in situ: широкое иссечение опухоли, лечение иммуномодуляторами.
І стадия: хирургическое удаление опухоли и участка здоровой кожи вокруг нее. Биопсия сигнального (сторожевого) лимфатического узла, при необходимости – удаление. Медикаментозная терапия.
II стадия: хирургическое удаление меланомы и участка здоровой кожи вокруг нее. Биопсия сигнального (сторожевого) лимфатического узла, при необходимости – удаление. Медикаментозная терапия для предупреждения рецидива заболевания.
ІІІ стадия: хирургическое удаление меланомы и участка здоровой кожи вокруг нее, а также сигнального лимфоузла, при необходимости – региональных и других участков, где обнаружены злокачественные клетки. Иммунно-, химио- и таргетная (молекулярно-прицельная) терапия.
IV стадия: иммунная и таргетная терапия, лучевой метод, препараты-ингибиторы сигнальной трансдукции, паллиативное лечение.
После удаления опухоли пациент регулярно обследуется в течение трех лет, когда высок риск рецидива меланомы.
Прогнозы выживаемости
По данным ВОЗ, ежегодно в мире диагностируют более 132 тысяч случаев меланомы. Заболевают чаще женщины, чем мужчины. Меланома может передаваться по наследству – около 10% случаев. Однако благодаря ранней диагностике и новым разработкам в области медицины в последние 10 лет повысилась общая выживаемость (до 5 лет) пациентов. Меланома на ранней стадии характеризуется положительным прогнозом в лечении и стойкой ремиссией у более чем 90% пациентов. Данные по статистике по пятилетней выживаемости: I степень (до 92%), ІІ степень (53–81%), ІІІ степень (40–78%), IV степень (15–20%).
Заболевают чаще женщины, чем мужчины. Меланома может передаваться по наследству – около 10% случаев. Однако благодаря ранней диагностике и новым разработкам в области медицины в последние 10 лет повысилась общая выживаемость (до 5 лет) пациентов. Меланома на ранней стадии характеризуется положительным прогнозом в лечении и стойкой ремиссией у более чем 90% пациентов. Данные по статистике по пятилетней выживаемости: I степень (до 92%), ІІ степень (53–81%), ІІІ степень (40–78%), IV степень (15–20%).
Иногда прогноз при меланоме IV степени даже лучше, чем, к примеру, ІІ или ІІІ степени, поскольку раковые клетки метастазируют в отдаленные участки кожи и лимфатические узлы, «обходя» важные органы и системы. Кроме того, при прогнозе обязательно учитывают уровень ЛДГ – если он в норме, то шансы на то, что болезнь отступит, еще больше повышаются.
На прогноз выживаемости влияет возраст пациентов. Так, у людей пожилого возраста шансов немного меньше, чем у молодых, причем независимо от стадии меланомы. От рака кожи чаще страдают белокожие люди, если же заболевание диагностируют у темнокожего человека, шансы на выживаемость его более низкие. Тем, кто перенес пересадку органов, имеет ВИЧ, серьезные хронические заболевания, также дают худшие прогнозы на выздоровление.
От рака кожи чаще страдают белокожие люди, если же заболевание диагностируют у темнокожего человека, шансы на выживаемость его более низкие. Тем, кто перенес пересадку органов, имеет ВИЧ, серьезные хронические заболевания, также дают худшие прогнозы на выздоровление.
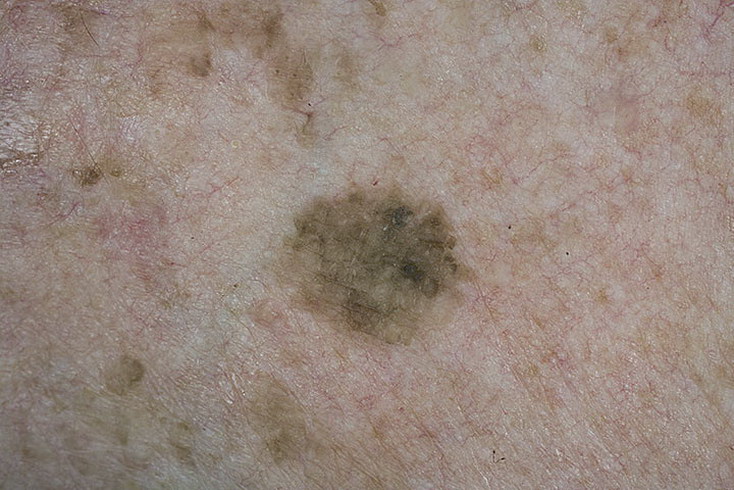
Признаки меланомы
Меланома – опасная форма рака, развивается незаметно, но стремительно, быстро метастазирует в лимфоузлы, переходя затем на внутренние органы и ткани. Именно поэтому так важна своевременная диагностика, которая повышает шансы пациента на выздоровление. Рак кожи на начальной стадии имеет характерные симптомы. Правило АВСD – основной маркер для меланомы:
- А (Аsymmetry) – асимметрия: края родинки или невуса не симметричны;
- В (Border) – границы: края новообразования неровные, нечеткие, зазубренные;
- С (Color) – цвет: окраска родинки неравномерная, есть оттенки коричневого, серого, иногда встречаются вкрапления розовых, красных или белых пятен;
- D (Diameter) – диаметр: диаметр образования более 6 мм и постепенно увеличивается в размерах.

Начальная стадия меланомы кожи может проявляться такими симптомами: зуд, жжение, болезненность, кровоточивость, появление на поверхности новообразования чешуек и язв. Самый главный признак – это то, что пятно сильно выделяется на фоне других родинок. При любых тревожных признаках следует обратиться к онкологу.
Материалы, использованные при подготовке статьи
О меланоме, ранней диагностике заболевания, а также о классификации стадий можно узнать из таких источников:
http://www.cancerresearchuk.org/about-cancer/melanoma/stages-types
https://www.cancer.net/cancer-types/melanoma/stages
https://www.medicinenet.com/melanoma/article.html
https://www.medicalnewstoday.com/articles/154322.php
https://www.cancer.org/cancer/melanoma-skin-cancer/detection-diagnosis-staging/melanoma-skin-cancer-stages.html
симптомы, стадии, прогноз, лечение, лучевая терапия.
Почему возникают «злокачественные родинки»?
Меланоциты трансформируются в опухолевые клетки, когда в их генах происходят определенные мутации. Основная причина этих мутаций – ультрафиолетовое излучение. Опасно долго находиться под солнечными лучами, посещать солярии. Всякий раз, когда человек «обгорает» на солнце, его риски повышаются. Ультрафиолетовые лучи особенно опасны для детей, людей со светлой кожей.
Основная причина этих мутаций – ультрафиолетовое излучение. Опасно долго находиться под солнечными лучами, посещать солярии. Всякий раз, когда человек «обгорает» на солнце, его риски повышаются. Ультрафиолетовые лучи особенно опасны для детей, людей со светлой кожей.
Другие факторы риска:
- Возраст старше 40 лет.
- Много родинок на теле (если больше 100 – риск сильно повышен).
- Атипичные, большие родинки.
- «Старческие пятна» на коже.
- Близкие родственники, у которых диагностирована меланома.
Стадии
Стадию меланомы кожи определяют в зависимости от глубины прорастания опухоли, наличия опухолевых клеток в близлежащих лимфоузлах, отдаленных метастазов:
- Самая ранняя стадия меланомы 0 – это «рак на месте». Опухоль находится в поверхностном слое кожи и не прорастает вглубь.
- На 1 стадии опухоль прорастает на глубину до 2 мм.
- Меланома 2 стадии прорастает в кожу на глубину до 4 мм.
 Иногда она имеет изъязвленную поверхность.
Иногда она имеет изъязвленную поверхность.
- Меланома 3 стадии распространяется в регионарные лимфатические узлы. При этом опухоль нередко успевает вторгнуться в кожу на глубину более 4 мм, имеет изъязвленную поверхность.
- Если обнаруживают отдаленные метастазы, диагностируют 4 стадию. Чаще всего меланома метастазирует в легкие, печень, головной мозг.
Симптомы меланомы кожи
На то, что родинка перестала быть безобидной, могут указывать следующие признаки:
- Асимметрия. Если мысленно провести линию через середину доброкачественной родинки, обе ее половины окажутся примерно одинаковыми. Злокачественная опухоль асимметрична.
- Края. У доброкачественных родинок они ровные, у меланомы – неправильные, зубчатые.
- Цвет. У доброкачественных родинок он более-менее равномерный. В меланоме присутствуют разные цвета и оттенки.
- Размеры. Обычно диаметр меланомы больше, чем у карандаша (более 6 мм).

- Изменения. Если у родинки меняется диаметр, цвет, высота, форма – нужно обратиться к врачу.
Диагностика меланомы
Самый надежный способ разобраться, является ли родинка злокачественной – биопсия. Врач удаляет новообразование и отправляет в лабораторию для изучения под микроскопом. Если в образце обнаружены раковые клетки, диагноз не вызывает сомнений.
В качестве скринингового теста применяют дерматоскопию – исследование, во время которого врач осматривает кожу пациента под увеличением с помощью специального инструмента. Современное оборудование позволяет заносить полученные изображения в компьютер и составлять «карту родинок», сравнивать картину в динамике. Если во время дерматоскопии обнаруживают подозрительные новообразования, проводят их биопсию.
Если есть подозрение на метастазы в других органах, назначают дополнительные исследования:
- Рентгенографию грудной клетки.
- Компьютерную томографию.

- Магнитно-резонансную томографию.
- ПЭТ-сканирование.
- Биопсию органов, в которых обнаружены подозрительные очаги.
Современные методы лечения
Лечение меланомы зависит от стадии, размеров и расположения первичной опухоли, наличия очагов в лимфатических узлах, отдаленных метастазов.
Хирургическое лечение
Основной вид операции при меланоме – широкое иссечение новообразования. Хирург удаляет опухоль и участок окружающей ткани вокруг нее. Для того чтобы убедиться в том, что меланома удалена полностью, ткани отправляют на биопсию, исследуют край резекции.
Если опухоль большая и находится на руке или ноге, приходится прибегать к ампутации. Если обнаружены очаги в лимфатических узлах, их тоже удаляют.
На 4 стадии радикальная операция невозможна. Даже если обнаружен всего один метастаз в каком-либо органе, скорее всего, есть и другие, просто они настолько малы, что не могут быть выявлены.
Химиотерапия
Химиотерапию обычно назначают на поздних стадиях, когда хирургическое лечение меланомы невозможно. Применяют разные химиопрепараты: дакарбазин, паклитаксел, карбоплатин, цисплатин, винбластин. В настоящее время к химиотерапии прибегают не так часто, потому что появились новые, более эффективные методы лечения:
- Таргетная терапия. Используют препараты, которые блокируют определенные молекулы-мишени, необходимые для выживания и размножения опухолевых клеток. Таргетная терапия действует более целенаправленно по сравнению с химиотерапией, вызывает меньше побочных эффектов.
- Иммунотерапия. Наиболее современные препараты для лечения меланомы – ингибиторы контрольных точек. Они блокируют молекулы, которые раковые клетки используют для подавления активности иммунитета. Ингибиторы контрольных точек назначают при поздних стадиях, когда неэффективны другие виды лечения.
Современная разновидность лечения меланомы рук и ног – изолированная перфузия конечностей. При этом руку или ногу как бы «отключают» от общей системы кровообращения. В артерию через катетер подают раствор химиопрепарата, а кровь по венам оттекает через катетер в специальный аппарат. Для того чтобы лекарство могло эффективно уничтожать опухолевые клетки, раствор подогревают примерно до 42 °C. Такая химиотерапия называется гипертермической.
При этом руку или ногу как бы «отключают» от общей системы кровообращения. В артерию через катетер подают раствор химиопрепарата, а кровь по венам оттекает через катетер в специальный аппарат. Для того чтобы лекарство могло эффективно уничтожать опухолевые клетки, раствор подогревают примерно до 42 °C. Такая химиотерапия называется гипертермической.
Лучевая терапия
Лучевую терапию при меланоме применяют в следующих случаях:
- Для уменьшения симптомов при метастазах, особенно в мозге, костях.
- После операции при десмопластической меланоме – относительно редкой разновидности опухоли.
- Для предотвращения рецидива после удаления лимфатических узлов.
- При рецидиве опухоли в лимфатических узлах, различных органах.
Прогноз выживаемости
Прогноз при меланоме кожи определяется по пятилетней выживаемости и зависит от стадии:
- I стадия: 92–97%.
- II стадия: 53–81%.

- III стадия: 40–78%.
- IV стадия: 15–20%.
Куда обратиться за помощью?
Лечением меланом занимаются многие онкологические клиники в Москве. Мы сотрудничаем с лучшими онкоцентрами и подскажем, где можно получить лечение по современным стандартам:
Меланома стадии: 1б стадия прогноз, 4 стадии, 1 стадия, меланома на ранней стадии
Меланома — это злокачественная опухоль, которая развивается при трансформации меланоцитов — пигментных клеток кожи. Данное образование возникает преимущественно на коже, но может образовываться и в слизистых оболочках (ротовая полость, влагалище, уретра, мочевой пузырь), а также в глазном яблоке.
Определение стадии меланомы имеет решающее значение для определения прогноза заболевания и выбора тактики лечения. Например, при ранних стадиях для достижения хорошего результата достаточно хирургического иссечения новообразования. При распространенном процессе лечение дополняют иммунотерапией и таргетной терапией.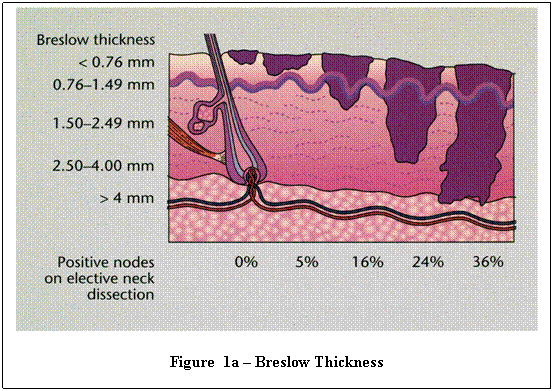 На 4 стадии, когда имеются метастазы во внутренние органы, для продления жизни больного может применяться химиотерапия.
На 4 стадии, когда имеются метастазы во внутренние органы, для продления жизни больного может применяться химиотерапия.
Для определения стадии меланомы используются следующие методы:
- Гистологическая верификация меланомы и определение степени ее инвазии в слои кожи и подкожную клетчатку.
- Определение наличия регионарных и отдаленных метастазов. Для этого используются методы медицинской визуализации (КТ, МРТ, ПЭТ, УЗИ), а также биопсия лимфоузлов и подозрительных очагов.
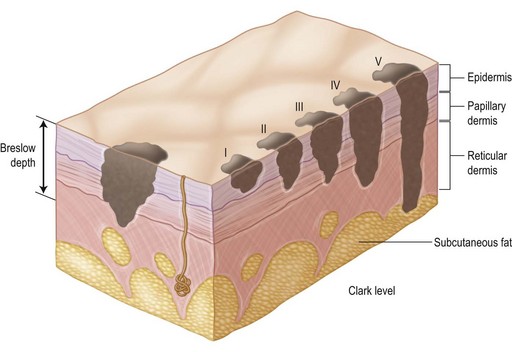
Стадии меланомы по Кларку
Стадирование меланомы по Кларку учитывает глубину прорастания новообразования, которая определяется во время морфологического исследования после полного хирургического удаления опухоли. В данном случае выделяют следующие уровни поражения:
- 1 уровень — злокачественные меланомные клетки находятся в пределах эпидермиса, на дерму процесс не распространяется. Такая стадия соответствует процессу in situ.
- 2 уровень — меланомные клетки прорастают базальную мембрану и затрагивают сосочковый слой дермы, точнее его верхнюю часть.
- 3 уровень — злокачественные меланоциты распространяются на всю толщину сосочкового слоя дермы, но не выходят за его пределы.
- 4 уровень —клетки меланомы распространяются на сетчатый слой дермы.
- 5 уровень — меланомые клетки выходят за пределы всех слоев кожи и распространяются на подкожную жировую клетчатку.
На определении степени глубины инвазии основывается еще один способ стадирования меланомы — стадирование по Бреслоу. Он предложил классифицировать опухоль в зависимости от ее толщины, что по его мнению ассоциировано с прогнозом заболевания. Например, при 1 стадии меланомы инвазия соответствует толщине опухоли менее 0.75 мм, и по мнению автора гарантирует безрецидивное течение при своевременном удалении. Если опухоль распространилась на толщину до 1,5 мм, то ожидается высокая вероятность наличия метастазов в регионарные лимфатические узлы. При превышении толщины меланомы более чем 1,5 мм возрастает вероятность гематогенного метастазирования. И, наконец, при 4 стадии инвазии, когда меланома имеет толщину более 4 мм, прогноз неблагоприятный, поскольку ожидается появление множественных лимфогенных и гематогенных метастазов в ближайшие сроки наблюдения.
Стадии меланомы по TNM
Стадирование меланомы согласно системе TNM основано на определении степени инвазии опухоли (кодируется буквой Т, от слова tumor — опухоль), вовлечения в процесс лимфатических узлов (N — nodus — узел), и наличия отдаленных метастазов (кодируется буквой М — metastasis — метастазы).
Критерий Т оценивается гистологически после удаления меланомы, критерии N и М оцениваются с помощью клинических и инструментальных методов исследования, например, пальпации, УЗИ, КТ или МРТ.
Классификация меланомы по критерию Т
рТх — данных для гистологической оценки толщины меланомы недостаточно. Такие ситуации возникают при спонтанном регрессе меланомы, или при повреждении опухоли во время ее хирургического иссечения.
рТ0 — первичной опухоли нет.
РТis — меланома in situ, что соответствует 1 уровню инвазии по Кларку, когда злокачественые меланомные клетки располагаются только в эпидермальном слое. Клинически диагноз может звучать как меланоцитарная дисплазия.
рТ1 — меланома с первой стадией инвазии по Бреслоу, т.е. менее 1 мм. Эта стадия делится на 2 подстадии:
- рТ1а — опухоль затрагивает сосочковый слой дермы (в том числе на всю его толщину), но на ее поверхности нет изъязвлений.
- РТ1b — опухоль распространяется за пределы сосочкового слоя, и распространяется на сетчатый слой дермы или подкожную клетчатку, либо опухоль не выходит за пределы сосочкового слоя, но на ее поверхности есть изъязвления.
рТ2 — меланома со степенью инвазии по Бреслоу в пределах 1-2 мм. Делится на 2 стадии:
- рТ2а — на поверхности меланомы нет изъязвлений.
- РТ2b — на поверхности меланомы есть изъязвления.
рТ3 — меланома со степенью инвазии по Бреслоу в пределах 2-4 мм. Делится на 2 стадии:
- рТ3а — на поверхности меланомы нет изъязвлений.
- РТ3b — на поверхности меланомы есть изъязвления.
рТ4 — меланома со степенью инвазии по Бреслоу более 4 мм. Делится на 2 подстадии:
- рТ4а — на поверхности меланомы нет изъязвлений.
- РТ4b — на поверхности меланомы есть изъязвления.
Классификация меланомы по критерию N
Как мы уже говорили, критерий N учитывает наличие метастазов меланомы в регионарных лимфатических узлах. Если метастазы в лимфоузлах обнаруживаются за пределами регионарных зон, их относят к критерию М, т. е. к отдаленным метастазам. Классификация по критерию N выглядит следующим образом:
Nx — невозможно определить или исключить наличие метастазов меланомы в лимфоузлах.
N0 — метастатического поражения нет.
N1 — имеются метастазы в одном лимфатическом узле. В данном случае возможны следующие подстадии:
- N1а — с помощью метода медицинской визуализации метастазы не определяются, а выявляются только при помощи биопсии.
- N1b — увеличение лимфоузла определяется клинически или с помощью методов медицинской визуализации.
N2 стадия диагностируется при обнаружении одного из следующих критериев:
- Метастазами поражены 2-3 регионарных лимфоузла.

- Имеются сателлитные метастазы — меланомные клетки или очаги, обнаруживаемые макро или микроскопически в пределах до 2 см от первичной меланомы.
- Имеются транзитные метастазы — кожные метастазы или метастазы в подкожную клетчатку на расстоянии, превышающем 2 см от первичной меланомы, но не выходящие за пределы регионарных лимфатический узлов.
В данной ситуации выделяют следующие подстадии:
- N2a — имеются клинически неопределяемые микрометастазы в 2-3 регионарных лимфатических узла.
- N2b — имеются визуально определяемые метастазы в 2-3 лимфатических узлах.
- N2c — имеются либо сателлитные, либо транзитные метастазы меланомы без вовлечения в процесс регионарных лимфоузлов.
Классификация по критерию М (наличие отдаленных метастазов)
Как мы уже говорили, отдаленными являются все метастазы, выходящие за пределы зоны регионарных лимфатических узлов, либо поражающие внутренние органы. Здесь выделяют следующие варианты:
- М0 — отдаленные метастазы отсутствуют.
- М1 — отдаленные метастазы есть. При этом данная стадия делится на следующие подстадии:
- М1а — имеется метастатическое поражение кожи, подкожной клетчатки и лимфатических узлов (не регионарных) при нормальном уровне лактатдегидрогеназы (ЛДГ).
- М1b — метастазами меланомы поражены легкие, уровень ЛДГ в норме.
- М1с — имеются метастазы в другие внутренние органы, либо метастазы в кожу, подкожную клетчатку или лимфоузлы с повышенным уровнем ЛДГ.
4 клинические стадии меланомы
Клинически выделяют 4 стадии меланомы, при этом учитывается как степень инвазии опухоли, так и наличие регионарных и отдаленных метастазов.
- 0 стадия — меланома in situ. Она не распространяется за пределы базальной мембраны, метастазов нет.
- 1 стадия — здесь есть два варианта. Либо толщина меланомы по Бреслоу до 1 мм, при этом может быть изъязвление ее поверхности (1А стадия), либо толщина до 2 мм, но без повреждения поверхности меланомы. Метастазов нет (1b стадия).
- 2 стадия меланомы также делится на несколько подстадий:
- 2а — толщина меланомы 2-3 мм без изъязвления ее поверхности.
- 2b — толщина меланомы 1-2 мм, но с изъязвлением поверхности.
- 3 стадия характеризуется наличием метастазов в регионарных лимфоузлах.
- 4 стадия — имеется поражение внутренних органов либо метастазы в отдаленных лимфоузлах.
Метастазы
Метастазирование представляет собой сложный процесс, при котором из первичного опухолевого очага отсеиваются злокачественные клетки и колонизируют лимфатические узлы, внутренние органы и ткани. В результате образуются вторичные очаги опухолевого роста. Для реализации процесса метастазирования необходимы следующие механизмы:
- Изменение поверхности злокачественных клеток.
- Увеличение подвижности злокачественных клеток.
- Способность к адгезии — прикреплению на новом месте.
- Активация механизмов отбора опухолевых клеток с высоким метастатическим потенциалом.
- Попадание отдельных злокачественных клеток или их конгломератов в просветы кровеносных или лимфатических сосудов и их транспортировка.
- Вторичная инвазия эндотелия сосудов и выход злокачественных клеток из сосудистого русла.
- Инфильтрация окружающих тканей.
Если говорить о меланоме, то метастазы часто обнаруживаются уже в первый год после диагностики заболевания, в том числе и после радикального удаления опухоли. При увеличении промежутка безрецидивной выживаемости, вероятность возникновения метастазов снижается и достигает минимума через 7 лет от момента радикального лечения. Однако известны случаи позднего метастазирования меланомы, когда вторичные очаги обнаруживались через 10 и более лет. Описаны также случаи образования метастазов и через 25 лет после радикальной операции.
Прогноз выживаемости по стадиям
При 0-1 стадии меланомы пятилетней выживаемости удается достичь в 96-99% случаев.
При меланоме второй стадии при отсутствии метастазов на момент постановки диагноза пятилетняя выживаемость колеблется в пределах 80-87%.
При меланоме 3 стадии прогноз определяется количеством пораженных лимфоузлов на момент постановки диагноза. Если это 1 узел, пятилетней выживаемости удается достичь у 45-50% пациентов, если поражено 2-3 лимфоузла, только 15-20% больных переживает пятилетний рубеж.
И наконец, прогноз при меланоме 4 стадии наиболее неблагоприятен. Пятилетний рубеж в этом случае переживают менее 5% больных.
факторы прогноза и отдаленные результаты хирургического лечения – тема научной статьи по клинической медицине читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
проникающих через гематоэнцефалитический барьер. Из иммунотерапевтических препаратов наибольшее распространение получили интерлейкин 2 (ронколейкин) в комбинации с а2 интерферонами (роферон, интрон А). Так, из 3 больных, получавших химиоиммунотерапию в 20002005 гг., в настоящее время живы все, причем 2 из них наблюдаются более 7 лет.
выводы
1. 34,2% больных с диагнозом ММБВПО ранее проводилось оперативное лечение по поводу предполагаемых доброкачественных образований или неопухолевых заболеваний кожи.
2. ММБВПо несколько чаще встречаются у женщин, с одинаковой частотой поражаются паховые и подмышечные группы лимфатических узлов. отмечается высокая частота МТС беспигментных меланом.
3. Прогноз при ММБВПО, в сравнении с синхронно развившимися МТС меланомы кожи в лимфатические узлы, менее благоприятный.
Литература
1. Иконописов Р., Райчев Р., Киров С. и др. Пигментные опухоли. — София: Медицина и физкультура, 1977. — 268 с.
2. Комаров И.Г., Комов Д.В. Метастазы злокачественных опухолей без выявленного первичного очага. — М.: Триада-Х, 2002. — 136 с.
3. Фрадкин С.З., Залуцкий И.В. Меланома кожи. — Минск: Беларусь, 2000. — 221 с.
4. Яворский В.В. Некоторые вопросы клиники, диагностики и лечения меланом кожи: Автореф. дис. … д-ра мед. наук. — М., 1975. — 36 с.
5. Baldi A., Dragonetti E., Battista T. et al. Detection of circulating malignant cells by RT-PCR in long-term clinically disease — free I stage melanoma patients // Anticancer Res. -2000. — Vol. 20, №5(C). — P. 3923-3928.
6. Brogelli L., Reali U.M., Moretti S. et al. The prognostic significance of histologic regression in cutaneous melanoma // Melanoma Res. — 1992. — Vol. 2, №2. — P. 87-91.
7. Nava M., Clemente C., Sacchini V. et al. Melanoma a sede primitiva ignota // Argomenti oncol. — 1988. — Vol. 9, №3. — P. 311-315.
8. Taran J.M., Heenan P.J. Clinical and histologic features of level 2 cutaneous malignant melanoma with metastasis // Cancer. — 2001. — Vol. 91, №9. — P. 1822-1825.
Координаты для связи с авторами: Марочко А.Ю. тел. 8-(4212)-76-09-77
□□□
удК 616.5 — 006.81 — 089-037 А.Ю. марочко
меланома кожи 1 стадии: факторы прогноза и отдаленные результаты хирургического лечения
Дальневосточный государственный медицинский университет, г. Хабаровск
Согласно клинической классификации ТЫМ Международного противоракового союза, к меланоме кожи (Мк) 1 стадии относят опухоли, инфильтрирующие папиллярный слой (2 уровень инвазии — Т1) или границу сосочково-сетчатого слоя кожи (3 уровень инвазии — Т2) при отсутствии метастазов (МТС) в регионарных лимфатических узлах (ЛУ) — Т1, 2ШМ0. В настоящее время единственным методом лечения таких больных является иссечение пигментного образования, отступив от края не менее 3-4 см при локализации опухоли на коже туловища или конечностей и 2 см — при поражении кожи в области головы и шеи, с пластикой образовавшегося дефекта местными тканями или свободным кожным лоскутом [5].
Целью нашей работы было изучить факторы, влияющие на выживаемость больных Мк 1 стадии после проведенного радикального хирургического лечения.
материалы и методы
Изучены данные анамнеза, проведенных клинико-диагностических и лечебных мероприятий, 5- и 10-летняя выживаемость 164 больных МК 1 стадии (Т1, 2Ы0М0), получивших лечение в различных клинических учреждениях г. Хабаровска в 1990-1999 гг. Судьба больных прослежена до мая 2008 г.
Результаты и обсуждение Из 331 больного МК, наблюдавшего нами в рассматриваемый период, на долю пациентов с 1 стадией заболевания приходилось 49,6%. Несколько чаще 1 стадия МК отмечалась у женщин (53,9% от всех опухолей), чем у мужчин (42,3%). Причем, если у женщин в возрасте 029 и старше 70 лет 1 стадия встречалась соответственно у 81,8 и 63,0% больных, то у мужчин после 60 лет она отмечена только у 30,6%.
Вследствие диагностических ошибок 54 пациентам (32,9%) проведено нерадикальное оперативное лечение, причем 30 из них операция выполнялась под местной анестезией, что является недопустимым [5]. однако наибольшее значение для прогноза имели сроки повторной, радикальной операции. Так, при ее проведении в течение первых 5 нед. 5-летняя выживаемость больных, первоначально оперированных под местной анестезией (93,8%), была в 3,3 раза выше, чем оперированных в более поздние сроки (р<0,001).
известно, что прогноз при Мк у женщин более благоприятный [5]. Подобная ситуация наблюдалась и в нашем исследовании при всех стадиях в целом. В то же время при 1 стадии половые различия были невыраженными, а показатели 5- и 10-летней выживаемости мужчин (65,4 и 52,5%) и женщин (72,3 и 55,3%) отличались несущественно.
Среди отдельных локализаций наиболее благоприятный прогноз отмечался при Мк верхних конечностей, значительно ниже была выживаемость при опухолях кожи спины и области головы и шеи. одной из задач, поставленных нами, было выяснить, какие факторы оказывают наибольшее влияние на прогноз при 1 стадии Мк.
Уровень инвазии. как известно, для классификации Мк по критерию «Т» учитывают: 1) толщину опухоли по Л. Breslow в мм и 2) уровень инвазии по W. Clarc. В настоящее время, по мнению большинства исследователей, фактором, определяющим прогноз, является толщина опухоли, а уровень инвазии имеет значение при Мк толщиной менее 1 мм [2-4]. В то же время В.В. Анисимов [1] считает критерий кларка более точным и рекомендует учитывать оба фактора. к сожалению, до недавнего времени толщина опухоли у больных Мк в Хабаровском крае не всегда определялась, поэтому в нашей работе мы ориентировались только на уровень инвазии.
как видно из табл. 1, прогноз при 2 уровне инвазии Мк у мужчин был более благоприятным, чем при 3 уровне. Эти различия отмечались как при 5-летнем сроке наблюдения, так и через 10 лет (р<0,01 и р<0,01). У женщин влияние уровня инвазии на выживаемость было менее выраженным и становилось значимым только спустя 10 лет после операции (р<0,05). Следует отметить, что уже при Т2 прогноз у женщин был значительно лучше (р<0,05).
Таблица 1
Влияние уровней инвазии на 5- и 10-летнюю выживаемость больных 1 стадией МК (М±т, %)
Таблица 2
Влияние изъязвления опухоли на 5-и 10-летнюю выживаемост ь больных 1 стадией МК (M±m, %)
Характер опухоли Мужчины Женщины
5 лет 10 лет 5 лет 10 лет
МК без изъязвления 74,2±7,9 65,2±10,2 82,4±4,6 70,8±6,6
МК с изъязвлением 52,4±11,2 35,3±11,9 56,8±7,5 28,6±8,7
Резюме
Изучена 5- и 10-летняя выживаемость 164 больных ме-ланомой кожи 1 стадии. При этом половые различия были незначительными. Соответствующие показатели составили 65,4 и 52,5% у мужчин и 72,3 и 55,3% — у женщин. Наибольшее влияние на отдаленные результаты лечения оказывали уровень инвазии, наличие изъязвления и предшествующего пигментного невуса. Были нерадикально оперированы 32,9% больных вследствие диагностических ошибок. Проведение повторной, радикальной операции в течение 5 нед. не ухудшало прогноз.
Ключевые слова: меланома кожи, уровень инвазии, изъязвление, выживаемость.
A.Y. Marochko
SKIN MELANOMA OF 1-ST STAGE: PROGNOSIS FACTORS AND REMOTE RESULTS OF SURGICAL TREATMENT
Far Eastern State Medical University, Khabarovsk Summary
5- and 10-year survival rate of 164 patients with skin melanoma of the I-st stage was studied. Gender differences were insignificant. These indices were 65, 4 and 52,5% in male and 72,3 and 55,3% in female. The most important factors effecting remote results of treatment were: invasion level, presence of ulceration and pigment nevus. 32,9% patients underwent non-radical treatment because of diagnostic mistakes. Conduction of repeated radical operation in 5 weeks do not worsen prognosis.
Key words: melanocarcinoma, invasion level, ulceration, survival.
Важное значение имеет и частота появления МТС в регионарных ЛУ в послеоперационном периоде. Так, при Т1 в ходе диспансерного наблюдения МТС в ЛУ диагностированы у 12,0% больных, а при Т2 — у 31,3% (р<0,05). В целом, можно сказать, что показатели 10-летней выживаемости как у мужчин, так и у женщин существенно ниже, чем 5-летней, что особенно заметно при 3 уровне инвазии МК. В этой связи мы поддерживаем мнение В.В. Анисимова [5], что для больных 1 стадией МК 5-летний период наблюдения является недостаточным.
Вторым по значимости фактором прогноза считается наличие изъязвления опухоли [1-3]. Изъязвление МК наблюдалось у 39,6% пациентов, с одинаковой частотой у мужчин и женщин. Из табл. 2 видно, что изъязвление опухоли ухудшало прогноз. Причем у женщин эти различия были выражены в большей степени (р<0,05) и увеличивались с течением времени (р<0,01).
Как известно, определенная часть МК возникает на месте доброкачественных пигментных образований — невусов, другие — на внешне неизмененной коже — de novo. Однако влияние этих факторов на прогноз при МК 1 стадии до настоящего времени в литературе не рассматривалось.
Все МК, возникшие на месте врожденных либо существующих более 10 лет невусов, были нами объеди-
Уровень инвазии Мужчины Женщины
5 лет 10 лет 5 лет 10 лет
2-й 92,6±5,1 81,8±8,4 78,7±5,2 68,9±6,9
3-й 36,0±9,8 16,7±9,0 64,7±6,7 35,5±8,6
Таблица 3
Влияние фона возникновения МК 1 стадии на 5- и 10-летнюю выживаемость больных (М±т, %)
Фон возникновения опухоли Мужчины Женщины
5 лет 10 лет 5 лет 10 лет
На фоне невуса 66,7±9,2 52,9±12,5 82,4±5,3 69,7±8,0
De novo 61,1±11,8 52,9±12,5 60,0±7,3 45,5±8,7
нены в группу невогенных МК (78 случаев — 47,6%), вторую группу составили МК de novo, т.е. развившиеся на неизмененной коже с длительностью анамнеза до 5 лет [5] — 63 больных (38,4%).
Как видно из табл. 3, прогноз при невогенной МК был лучше, особенно это заметно у женщин как при 5-летнем сроке наблюдения (р<0,05), так и через 10 лет (р<0,05). Возможно, столь выраженные различия в определенной степени связаны с большей частотой среди женщин с МК de novo лиц старше 70 лет. В то же время известно, что у пожилых наблюдается неблагоприятное течение опухоли [5].
Выводы
1. На долю 1 стадии приходится 49,6% больных МК.
2. Больные с 1 стадией МК представляют гетерогенную группу. При этом определяющим для прогноза является уровень инвазии опухоли.
3. Возникновение МК на неизмененной коже и изъязвление опухоли значительно ухудшают прогноз заболевания.
4. Вследствие диагностических ошибок 32,9% пациентов выполнены нерадикальные оперативные вмешательс-
тва. При этом важным для прогноза является проведение повторной, радикальной операции в течение 5 нед.
5. Анализ 10-летней выживаемости позволяет получить дополнительную информацию об особенностях течения МК 1 стадии.
Литература
1. Анисимов В.В. Меланома кожи (перспективы улучшения диагностики и лечения): дис. … д-ра мед. наук. — СПб., 2000. — 97 с.
2. Averbook B.J., Fu P., Rao J.S., Mansour E.G. A long-term analysis of 1018 patients with melanoma by classic Coxregression and treestructured survival analysis at a major referral center: Implications on the future of cancer staging // Surgery. — 2002. — Vol. 32, №4. — P. 589-602.
3. Balch C.M., Bizaid A.C., Soong S.J. et al. Final version of the American Joint Committee on Cancer staging system for cutaneous melanoma // J. Clin. Oncol. — 2001. — Vol. 19 (16). — P.3635-3648.
4. Bizaid A.C., Ross M., Balch C.M. et al. Critical analysis of the current American Joint Committee on Cancer staging system for cutaneous melanoma and proposal of a new staging system // J. Clin. Oncol. — 1997. — Vol. 15. — P. 1039-1051.
5. Owen S.A., Sanders L.L., Edvards L.J. et al. Identification of higher risk melanomas should be based on Breslow depth not Clark level IV // Cancer. — 2001. — Vol. 91, №5. — P. 983-991.
Координаты для связи с автором: Марочко А.Ю. тел. 8-(4212)-76-09-77
□□□
Адъювантная терапия меланомы кожи uMEDp
Длительное время для лечения меланомы кожи в адъювантном режиме существовала только одна опция – препараты рекомбинантного интерферона альфа. Появление анти-CTLA-4-, анти-PD-1-ингибиторов и таргетной терапии ознаменовало начало новой эры эффективного лечения заболевания. Благодаря современным методам системной терапии показатели безрецидивной выживаемости значительно увеличились по сравнению с аналогичными показателями, которые наблюдались десять лет назад. В статье проанализированы результаты исследований адъювантной терапии II–IV стадий после полной циторедукции, а также освещены последние клинические рекомендации.Рис. 1. Показатели меланома-специфической выживаемости в зависимости от стадии (TNM, 8-е издание) [2]
Таблица 1. Риск прогрессирования и общая выживаемость в зависимости от стадии меланомы кожи
Таблица 2. Продолжающиеся исследования адъювантной терапии при меланоме II стадии [10]
Рис. 2. Исследование СheckMate 238: безрецидивная выживаемость у пациентов с меланомой III стадии
Рис. 3. Исследование KEYNOTE-054: безрецидивная выживаемость
Рис. 4. Исследование COMBI-AD: общая (А) и безрецидивная выживаемость (Б)
Рис. 5. Исследование СheckMate 238: безрецидивная выживаемость пациентов с меланомой IV стадии после полной циторедукции
Рис. 6. Исследование IMMUNED: безрецидивная выживаемость
Таблица 3. Рекомендуемые режимы адъювантной терапии меланомы кожи в зависимости от стадии заболевания
Введение
Меланома относится к злокачественным новообразованиям с агрессивным течением. Это связано прежде всего с высокой пролиферативной активностью и склонностью к регионарному и отдаленному метастазированию. Ключевыми прогностическими факторами в данном случае являются толщина опухоли по Бреслоу, наличие или отсутствие изъязвления, митотическая активность и поражение лимфатических узлов. Несмотря на то что меланома составляет меньшую часть всех опухолей кожи, она занимает первое место по смертности. Чаще диагноз меланомы в Российской Федерации устанавливают на I и II стадиях, в 20% случаев – при местнораспространенном или метастатическом заболевании [1].
Использование современных методов локального и системного лечения позволяет увеличить выживаемость пациентов, тем не менее благоприятный прогноз характерен только для ранних стадий. Пятилетняя выживаемость при I стадии достигает 97–99%, при II стадии – 75–94% в зависимости от наличия или отсутствия изъязвления опухоли. При III стадии, для которой характерно поражение лимфатических узлов и/или наличие транзиторных и/или сателлитных метастазов, этот показатель значительно ниже и варьируется от 32 до 93% (рис. 1) [2, 3].
В зависимости от стадии локальную меланому I–III стадий разделяют на три группы риска прогрессирования: низкий (IA–IIA), промежуточный (IIB, IIIA) и высокий (IIIB–IIID) (табл. 1).
Основными факторами разделения на группы риска являются толщина опухоли, наличие изъязвления, транзиторных и/или сателлитных и/или микросателлитных метастазов, высокий митотический индекс, лимфоваскулярная и периневральная инвазия. Кроме того, некоторые авторы выделяют BRAF-статус в качестве прогностического фактора. Показано, что меланомы с большей толщиной первичной опухоли имеют худший прогноз по сравнению с опухолями с меньшей толщиной и микроскопическим поражением регионарных лимфоузлов, что объясняется преобладанием гематогенного пути метастазирования меланомы [3].
Около десяти лет назад пятилетняя выживаемость при III стадии составляла 40–78%, в то время как при II стадии не превышала 53% [4]. В настоящее время благодаря разработке новых препаратов и их применению в адъювантном режиме удалось значительно увеличить безрецидивную и общую выживаемость.
Системное лечение пациентов с локальными (I–II) стадиями меланомы
Согласно 8-й редакции классификации TNM (TNM8), I стадия меланомы характеризуется толщиной опухоли менее 1 мм или от 1 до 2 мм без изъязвления. К II стадии относятся меланомы более 1 мм с изъязвлением и более 2 мм в отсутствие поражения регионарных лимфоузлов и отдаленных метастазов.
Необходимо отметить, что, согласно TNM8, для установления стадии заболевания всем пациентам должна быть выполнена биопсия сигнального лимфоузла (БСЛУ) при толщине опухоли более 0,8 мм с последующим гистологическим и иммуногистохимическим исследованиями. Данное вмешательство позволяет морфологически подтвердить диагноз локальной формы меланомы и исключить наличие регионарного метастазирования в лимфатические узлы, что соответствовало бы III стадии. При невыполнении БСЛУ регионарные лимфоузлы должны описываться как Nх [3].
Единственно одобренным подходом к лечению меланомы кожи I стадии в России, Соединенных Штатах Америки и Европе является радикальное иссечение первичной опухоли в пределах здоровых тканей. Адъювантную терапию, в том числе интерфероном (ИФН) альфа, при меланоме I стадии с низким риском прогрессирования и благоприятным прогнозом проводить не рекомендуется.
Первым этапом лечения меланомы кожи II стадии также является хирургический. Однако учитывая, что группа пациентов с меланомой кожи II стадии достаточно неоднородна и включает пациентов с низким (IIA), промежуточным (IIB) и высоким (IIC) риском прогрессирования (табл. 1), подходы к адъювантной лекарственной терапии различаются в зависимости от подстадии. Согласно рекомендациям Министерства здравоохранения РФ, Ассоциации онкологов России (АОР) и Российского общества клинической онкологии (RUSSCO), после радикального иссечения первичной опухоли при подтвержденной IIА стадии заболевания (группа низкого риска) какая-либо адъювантная терапия неэффективна и целесообразно проводить только динамическое наблюдение. При меланоме кожи изъязвленной формы IIB–IIC стадий рекомендовано начать адъювантную терапию ИФН-альфа в низких дозах (3–5 млн Ед подкожно три раза в неделю) не позднее девяти недель от операции. Терапия в совокупности проводится в течение года [5, 6].
Несмотря на то что в настоящее время для пациентов с меланомой кожи II стадии ИФН-альфа исключен из рекомендаций Американской ассоциации онкологов (NCCN), в рекомендациях Минздрава России, АОР и RUSSCO для пациентов с изъязвлением данная опция сохранена.
Как известно, предиктивным фактором чувствительности к терапии ИФН-альфа является именно наличие изъязвления первичной опухоли. Метаанализ 14 рандомизированных исследований применения ИФН-альфа в качестве адъювантной иммунотерапии меланомы кожи продемонстрировал статистически значимое увеличение безрецидивной (снижение относительного риска прогрессирования на 18%) и общей выживаемости (ОВ) (снижение относительного риска смерти на 11%) [7]. Отдельно следует отметить, что, согласно российским, европейским и американским рекомендациям, пациентам с II стадией меланомы кожи следует предлагать участие в клинических исследованиях при наличии такой возможности.
С учетом равнозначности рисков прогрессирования между локальной (II) и регионарной (III) стадиями сегодня назрела необходимость поиска новых эффективных подходов к адъювантной терапии меланомы II стадии. Например, десятилетняя ОВ при IIС стадии составляет 75%, что сопоставимо с десятилетней ОВ при IIIВ стадии (77%) меланомы, при которой применяется эффективное адъювантное лечение (рис. 1). На данный момент проходит ряд клинических исследований адъювантной терапии меланомы. Однако в большинство исследований пациенты с II стадией заболевания не включались.
Опубликованы данные рандомизированного исследования III фазы BRIM8, в котором изучали эффективность современной адъювантной терапии при II стадии меланомы у пациентов с положительным статусом BRAF и IIC–III стадиями заболевания после радикального лечения. Исследователи оценивали влияние вемурафениба (против плацебо) на ОВ и безрецидивную выживаемость (БРВ). Первичной конечной точкой была выбрана БРВ в когорте 2 (пациенты со стадией IIIC), которая не была достигнута. Несмотря на достоверное влияние на БРВ в когорте 1 (у пациентов с IIC, IIIA или IIIB медиана не достигнута по сравнению с 36,9 месяца, отношение рисков (ОР) 0,54; 95%-ный доверительный интервал (ДИ) 0,37–0,78), вемурафениб не был одобрен для назначения в послеоперационном режиме ни для II, ни для III стадий в России, Европе и США [8].
Продолжается поиск эффективной послеоперационной терапии II стадии меланомы кожи. Ожидаются результаты исследования KEYNOTE-716, посвященного оценке сравнительной эффективности ингибитора PD-1 пембролизумаба в адъювантном режиме у пациентов с резецированной меланомой высокого риска (IIB–C стадии) и плацебо [9].
В 2024 г. ожидаются результаты исследования NCT04099251, в котором изучают эффективность другого PD-1-ингибитора – ниволумаба для профилактического лечения меланомы аналогичной стадии после радикального иссечения первичной опухоли. В таблице 2 перечислены текущие исследования эффективности адъювантной терапии II стадии меланомы кожи [10]. Возможно, будет рассматриваться вопрос изучения в адъювантном режиме зарегистрированного в апреле 2020 г. для лечения метастатической меланомы отечественного препарата пролголимаба (anti-PD-1, BCD-100) [11].
Системное лечение пациентов с III стадией меланомы
Адъювантная терапия меланомы III стадии вне зависимости от статуса BRAF
До недавнего времени опции послеоперационного системного лечения были весьма ограниченны и стандартным подходом считалось назначение препаратов рекомбинантного ИФН-альфа. Так продолжалось до 2011 г., когда одобрили первый анти-CTLA-4-препарат и стали развиваться два новых направления в лечении меланомы – таргетная терапия и иммунотерапия.
Первым ингибитором контрольных точек иммунитета (check-point ингибитор), продемонстрировавшим эффективность в адъювантном режиме, был ипилимумаб – CTLA-4-ингибитор. Он был одобрен в США в 2015 г. на основании результатов III фазы рандомизированного исследования СА184-029/EORTC18071, в котором сравнивали ипилимумаб 10 мг/кг внутривенно капельно каждые три недели с плацебо. В исследуемые группы были включены пациенты с IIIA–C стадией меланомы после хирургического лечения [12]. На фоне применения ипилимумаба отмечалось значимое увеличение пятилетней БРВ (41 против 30% в группе плацебо, ОР 0,76; 95% ДИ 0,64–0,89; p
Впоследствии были получены результаты исследования E1609, в котором сравнивали ипилимумаб 3 или 10 мг/кг внутривенно капельно каждые три недели и высокодозный ИФН-альфа. Было продемонстрировано, что меньшая доза ипилимумаба увеличивает пятилетнюю ОВ по сравнению с ИФН-альфа (72 против 67%, ОР 0,78; 95% ДИ 0,61–0,99). Подобное увеличение ОВ не отмечалось при использовании ипилимумаба 10 мг/кг, что, вероятно, связано с прекращением лечения из-за токсичности более чем у половины пациентов [14]. С учетом выраженной токсичности данного препарата и наличия других опций для адъювантного режима ипилимумаб не рекомендован к применению в России, США и Европе и не включен в клинические рекомендации.
В 2017 г. появились результаты III фазы рандомизированного исследования СheckMate 238, в котором сравнивали новый ингибитор контрольных точек иммунитета, PD-1-ингибитор, ниволумаб 3 мг/кг (не более 240 мг) внутривенно капельно каждые две недели с ипилимумабом 10 мг/кг внутривенно капельно каждые три недели. В исследование СheckMate 238 были включены пациенты с IIIВ–С и IV стадиями после полной циторедукции. У 42% пациентов имелась мутация в гене BRAF [15]. Обновленные результаты трехлетней выживаемости были представлены на ежегодной встрече Европейского общества медицинской онкологии (ESMO) в 2019 г. По сравнению с ипилимумабом ниволумаб продемонстрировал преимущество в увеличении трехлетней БРВ, что являлось первичной конечной точкой исследования. У пациентов с III стадией она составила 60 и 46% соответственно (ОР 0,68; 95% ДИ 0,55–0,84) (рис. 2). Важно отметить, что увеличение БРВ на фоне ниволумаба не зависело от наличия или отсутствия мутации BRAF и уровня экспрессии PD-L1. Однако у пациентов с высокой экспрессией (PD-L1 ≥ 5%) выживаемость была лучше: 55 против 46% для группы PD-L1
Профиль токсичности ниволумаба значительно лучше такового ипилимумаба: только у 14% развились иммуноопосредованные нежелательные явления 3–4-й степени против 46% соответственно, что значительно реже приводило к отмене лечения (4 и 30% соответственно).
Впервые ниволумаб для адъювантной терапии III–IV стадии после хирургического лечения был зарегистрирован в США в 2017 г., позднее, в 2018 г. – в Европе и России. Согласно клиническим рекомендациям, в РФ ниволумаб показан для адъювантной терапии IIIB–D и IV стадии в течение 12 месяцев в дозе 3 мг/кг (не более 240 мг внутривенно капельно каждые две недели) или 480 мг внутривенно капельно каждые четыре недели.
Помимо ниволумаба в России, США и Европе в 2019 г. был зарегистрирован другой анти-PD-1-ингибитор – пембролизумаб. Его эффективность в адъювантном режиме превысила эффективность плацебо в рандомизированном клиническом исследовании III фазы KEYNOTE-054, в которое были включены пациенты с IIIA–C стадиями после хирургического лечения. Пембролизумаб назначался в фиксированной дозе 200 мг внутривенно капельно на 12 месяцев. На данный момент получены результаты с медианой наблюдения 18 месяцев.
По сравнению с плацебо кривая БРВ на фоне приема пембролизумаба была значительно выше. Так, на 18-м месяце наблюдения 71,4% пациентов были живы, а в группе плацебо – 53,2% (рис. 3).
Кроме того, БРВ оценивали в зависимости от мутационного статуса BRAF. 18-месячная БРВ в группе BRAFmut на фоне лечения составила 69,2 и 52,4% соответственно (ОР 0,57; 95% ДИ 0,37–0,89), в группе BRAFwt – 66,7 против 48,8% в группе плацебо (ОР 0,64; 95% ДИ 0,42–0,96). Выживаемость при положительном статусе PD-L1 была также лучше по сравнению с отрицательным уровнем экспрессии. Через 18 месяцев после начала лечения 74,2% пациентов были живы в группе PD-L1+ по сравнению с 54,5% в группе плацебо (ОР 0,54; 95% ДИ 0,42–0,69). Среди пациентов с PD-L1-отрицательным статусом аналогичная БРВ составила 60,6 и 52,2% соответственно (ОР 0,47; 95% ДИ 0,26–0,85) [18].
Пембролизумаб характеризуется благоприятным профилем токсичности. Иммуноопосредованные нежелательные явления возникли у 14,7% пациентов, в группе плацебо – у 3,4%. Однако была зафиксирована одна смерть на фоне лечения из-за миозита.
В РФ рекомендовано назначение пембролизумаба в адъювантном режиме при IIIA–D стадиях в дозе 200 мг внутривенно капельно каждые три недели в течение 12 месяцев. В начале этого года в США было одобрено применение пембролизумаба по схеме 400 мг внутривенно капельно каждые шесть недель, однако в России данная схема введения пока не зарегистрирована.
Суммируя сказанное, в арсенале врача-онколога есть несколько опций адъювантной терапии меланомы III стадии независимо от мутационного статуса BRAF: пембролизумаб и ниволумаб. Оба препарата относятся к иммунотерапии, характеризуются хорошей переносимостью и профилем токсичности, продемонстрировали клинически значимое увеличение БРВ по результатам рандомизированных клинических исследований.
Адъювантная терапия меланомы III стадии при наличии активирующей мутации в гене BRAF
Селективная блокада MAPK-сигнального пути является эффективной альтернативой иммунотерапии в случае положительного мутационного статуса BRAF, что позволяет расширить опции для адъювантного лечения. Результаты III фазы рандомизированного исследования эффективности комбинации дабрафениба и траметиниба по сравнению с плацебо в качестве адъювантной терапии COMBI-AD были опубликованы в 2017 г. Дабрафениб назначали в дозе 150 мг дважды в день, траметиниб – 2 мг ежедневно. Терапия продолжалась в течение года. Четырехлетняя БРВ в группе комбинации составила 54%, в группе плацебо – 38% (ОР 0,49; 95% ДИ 0,40–0,59; р
Комбинация BRAF- и МЕК-ингибиторов удовлетворительно переносится. Серьезные нежелательные явления, связанные с лечением, возникли у 27% получавших таргетную терапию и 4% принимавших плацебо. Токсичность, потребовавшая отмены лечения, зарегистрирована у 26 и 3% пациентов соответственно. На основании результатов исследования COMBI-AD дабрафениб в комбинации с траметинибом был одобрен в 2018 г. в качестве адъювантной терапии III стадии меланомы после радикального хирургического лечения в России, США, Европе. Данное показание включено в российские клинические рекомендации.
На сегодняшний день помимо вышеперечисленных таргетных препаратов изучаются другие BRAF- и МЕК-ингибиторы – энкорафениб и биниметиниб. В случае появления доказательств их эффективности, возможно, появится еще один вариант адъювантного лечения для BRAF-мутированной меланомы помимо комбинации дабрафениба и траметиниба.
Адъювантная терапия меланомы IV стадии после полной циторедукции
Ингибитор контрольных точек иммунитета, anti-PD, ниволумаб – единственный препарат, одобренный для послеоперационной терапии меланомы IV стадии после полной циторедукции в России, Европе и США. Его регистрационным рандомизированным исследованием является СheckMate 238. Его основные характеристики, а также профиль токсичности препарата описаны выше.
В подгрупповом анализе отдельно оценивали БРВ при IV стадии после полной циторедукции. Так, трехлетняя БРВ составила 54% в группе ниволумаба и 40% в группе ипилимумаба (ОР 0,71; 95% ДИ 0,46–1,08) (рис. 5). Увеличение трехлетней БРВ было сходным в подгруппах BRAFmut и BRAFwt [16].
Назначение ниволумаба после полной циторедукции при IV стадии в течение 12 месяцев включено в российские клинические рекомендации в двух режимах – один раз в две или четыре недели.
В 2019 г. на конгрессе ESMO были представлены результаты II фазы рандомизированного исследования IMMUNED. В этом исследовании 167 пациентов были рандомизированы на три группы:
- ниволумаб 1 мг/кг внутривенно капельно каждые три недели + четыре введения ипилимумаба 3 мг/кг внутривенно капельно каждые три недели с дальнейшим поддерживающим режимом ниволумаба в дозе 3 мг/кг внутривенно капельно каждые две недели;
- ниволумаб в монорежиме 3 мг/кг внутривенно капельно каждые две недели;
- плацебо.
Все три группы получали лечение в течение года [21].
Полученные результаты указывают на статистически достоверное преимущество комбинации ниволумаба и ипилимумаба в увеличении двухлетней БРВ. Так, в группе комбинации она составила 70%, в группе ниволумаба в монорежиме – 42% (ОР 0,40; 95% ДИ 0,22–0,73), в группе плацебо – 14% (рис. 6). Следует отметить, что в группе комбинации медиана БРВ на данный момент не достигнута, в группах ниволумаба и плацебо она составила 12,4 и 6,4 месяца соответственно.
Чаще нежелательные явления 3–4-й степени, связанные с лечением, возникали в группе комбинированной иммунотерапии (71%), реже – на фоне ниволумаба в монорежиме (27%). Токсичность, потребовавшая прекращения лечения, зафиксирована у 13% больных, принимавших ниволумаб, у 62% пациентов, получавших ипилимумаб и ниволумаб, и у 2% пациентов группы плацебо. Приведенные данные, несомненно, требуют подтверждения в ходе III фазы клинического исследования, однако можно предположить, что в ближайшем будущем возможны изменения в стандартной тактике системного лечения при меланоме IV стадии после полной циторедукции.
Возможные варианты адъювантной терапии меланомы II–III и IV стадий после полной циторедукции, согласно клиническим рекомендациям, представлены в табл. 3 [5, 6]. Следует подчеркнуть, что всем пациентам необходимо предлагать участие в клинических исследованиях, если имеется такая возможность.
Заключение
Меланома кожи длительное время оставалась заболеванием, против которого в арсенале врача-онколога имелись по сути только химиотерапия и препараты рекомбинантного ИФН-альфа. С появлением таргетной терапии и ингибиторов контрольных точек иммунного ответа лечебные опции расширились сначала для метастатической стадии, а впоследствии и для профилактики рецидива местнораспространенных стадий.
На нынешнем этапе развития онкологии нам удалось совершить огромный шаг вперед, увеличив безрецидивную выживаемость пациентов за счет назначения новых эффективных препаратов для послеоперационной системной терапии меланомы III стадии. К сожалению, остается много нерешенных вопросов: какая адъювантная терапия наиболее эффективна для IIВ–С стадий? какие предиктивные маркеры могут быть использованы для выбора одной из опций оптимальной терапии? появится ли в будущем возможность назначать иммунотерапию в неоадъювантном режиме и будет ли она эффективна? Несомненно, в обозримом будущем ответы на эти вопросы будут найдены. Но к тому моменту возникнут новые вопросы…
Прогноз при меланоме в зависимости от стадии
Каков мой прогноз? Сколько я буду жить с диагнозом «меланома»? Некоторые пациенты задают эти вопросы врачу и хотят быть в курсе сведений о выживаемости при данном заболевании, тогда как другие не желают о них слышать. Если вы не хотите знать об этом, то мы рекомендуем вам не читать этот текст и закрыть страницу.
Врачи не могут точно предсказать, сколько будет жить конкретный пациент. Прогноз для людей с меланомой зависит прежде всего от стадии заболевания. В целом, при более ранних стадиях меланомы наблюдаются лучшие показатели.
Но есть и другие факторы, которые могут повлиять на прогноз: расположение опухоли, возраст (у молодых людей шансы выше, чем у пожилых), общее состояние заболевшего, ответ на проводимое лечение и даже пол. Специалисты отмечают, что выживаемость среди женщин с меланомой немного выше, чем среди мужчин. Хотя последнее может быть связано с более внимательным отношением женщин к изменениям на теле и более частыми визитами к специалистам.
Врачи могут дать лишь приблизительную оценку перспектив лечения, основанную на средних статистических данных. Эти данные часто даются в виде показателей пятилетней выживаемости.
Что означает термин “5-летняя или 10-летняя выживаемость”?Говоря о пятилетней или десятилетней выживаемости, врачи имеют в виду процент пациентов, которые остаются в живых спустя, как минимум, 5 или 10 лет после выявления рака. Однако многие люди живут гораздо дольше. Например, 5-летняя выживаемость 80% означает, что 80 из 100 человек будут живы через 5 лет после постановки диагноза.
Существенные ограничения в понимании термина “выживаемость”.Цифры, которые будут представлены ниже, отражают ситуацию как минимум 5-летней давности. В настоящий момент эти цифры, возможно, несколько выше, так как появляются новые эффективные препараты и подходы к лечению рака.
Эти цифры получены по данным зарубежных исследований. В нашей стране подобная статистика ведется только в отдельных крупных регионах и может несколько отличаться от зарубежной, чаще в сторону снижения.
Представленные цифры относятся к ситуации, когда опухоль обнаружена впервые. Если речь идет о возврате заболевания, то на эти цифры обращать внимание не стоит.
5-летние показатели выживаемости при меланоме кожи в зависимости от стадии заболеванияСогласно данным отечественных исследователей 5-летняя выживаемость людей, заболевших меланомой кожи в 2003-2012 гг. без учета стадии заболевания в ряде регионов Российской Федерации составила 74%. По данным других исследователей, она ниже и составила к 2013 году 56,3%, а к 2014 – 57,1%. В Украине 5-летняя выживаемость за период с 2000 по 2005 года составила 49,7%. Та же выживаемость людей с меланомой кожи в США за период с 2005 по 2011 гг. достигла 93%. Значительная разница в выживаемости объясняется тем, что в РФ большинство случаев меланомы кожи диагностируются на второй стадии заболевания, тогда как в США – на первой.
В виду отсутствия сведений о выживаемости при меланоме кожи в зависимости от стадии заболевания в Российской Федерации, приводим данные выживаемости наблюдаемые в США.
|
Стадия |
5-летняя выживаемость |
10-летняя выживаемость |
|
IA |
97% |
95% |
|
IB |
92% |
86% |
|
IIA |
81% |
67% |
|
IIB |
70% |
57% |
|
IIC |
53% |
40% |
|
IIIA |
78% |
68% |
|
IIIB |
59% |
43% |
|
IIIC |
40% |
24% |
|
IV |
15-20% |
10-15% |
Дата создания: 28.04.2017 г.
Дата обновления: 28.04.2017 г.
Авторы: Руслан Абдуллаев, Нина Уманская
Метастазы в лимфоузлах | Прогноз, лечение
Метастазы в лимфоузлах при раке свидетельствуют о развитии злокачественного процесса до III или IV стадии. В процессе роста первичной опухоли от нее отделяются патологические клетки и попадают в лимфоток и кровеносные сосуды. В зависимости от того, лимфа или кровь стала путем распространения, это называется лимфогенным или гематогенным метастазированием. Сначала поражаются регионарные лимфоузлы — расположенные вблизи от опухоли. Позже раковые клетки могут мигрировать в отдаленные органы и, оставаясь там, провоцировать появление вторичных очагов.
Госпитализация онкологических больных. Ежедневно. Круглосуточно
Нам доверяют 9500 пациентов ежегодно.
До сих пор однозначно не выявлено, что служит спусковым крючком для агрессивного роста новообразования и его распространения на другие органы, но после появления метастазов в лимфоузлах прогноз по выживаемости заметно снижается. На скорость роста метастатических опухолей влияют такие факторы, как разновидность, размеры, расположение первичного новообразования, возраст и состояние иммунитета больного, анамнез.
Поскольку первичные злокачественные опухоли на ранних стадиях не дают выраженной симптоматики, во многих случаях сначала диагностируется именно метастатическое поражение лимфатической системы, а уже потом определяется основной диагноз. По степени тяжести выделяют 3 стадии:
- легкая — 1–3 узла;
- средняя — 4–9;
- тяжелая — 10 и более.
Симптомы болезни:
- снижение иммунитета, частые простуды и т. д.;
- повышенная утомляемость, слабость;
- температура выше нормальной, на которую не влияют жаропонижающие средства;
- мигрени и невротические расстройства;
- увеличение лимфатических узлов в размерах, их болезненность.
Наш эксперт в этой сфере:
Иванов Антон Александрович
Медицинский директор, врач онколог-хирург, к.м.н
Связь лимфотока и локализации вторичных новообразований
На метастазирование влияет ход тока лимфы. Например, метастазы в лимфоузлах от опухолей легких и молочной железы — это в основном зона над ключицей, от крестца, ног и наружных половых органов — в паховой области. При опухолях языка, глотки, гортани, щитовидной железы обычно развиваются метастазы в лимфоузлах шеи. Однако на IV стадии это правило не работает, поскольку раковые клетки уже распространились по всему организму — новые раковые образования могут разрастаться в любом органе.
Учитывая интенсивность лимфотока в различных органах, метастазы в лимфоузлах чаще всего приводят к поражениям печени, легких, надпочечников. Подобные локализации свидетельствуют о терминальной стадии рака, в том время как регионарные лимфатические узлы могут поражаться и на третьей, когда шансы на восстановление выше.
Метастазы в лимфоузлах — лечение и прогнозы
Для диагностики используют МРТ, КТ, биопсию и гистологические исследования лимфы. Делать это необходимо при первых же подозрениях на диагноз, чтобы при необходимости начать лечение как можно раньше.
Отправьте документы на почту [email protected]. Возможность проведения лечения рассмотрит главный врач клиники Антон Александрович Иванов, онколог-хирург, кмн
Одновременно с хирургическим удалением первичной опухоли обычно удаляют пораженные узлы. При этом делается все необходимое, чтобы раковые клетки не мигрировали в кровь. Как правило, используется и химиотерапия — препараты эффективно уничтожают агрессивные клетки или препятствуют их дальнейшему делению. Радиотерапия применяется реже, но позволяет уничтожить фрагменты опухолей, локализация которых хорошо определяется.
В каждом случае используемые методы определяются индивидуально. Клиника НАКФФ обладает всеми ресурсами, чтобы по возможности быстро и эффективно провести диагностические и лечебные мероприятия, организовать реабилитацию после лечения или оказать паллиативную помощь. Запишитесь на первичную консультацию по телефону +7 (495) 259-44-44.
Выживание | Рак кожи меланома
Выживание зависит от многих факторов. Никто не может сказать вам точно, сколько вы проживете.
Это общая статистика, основанная на больших группах людей. Помните, они не могут сказать вам, что произойдет в вашем конкретном случае.
Ваш врач может дать вам дополнительную информацию о вашем собственном прогнозе. Вы также можете поговорить об этом с медсестрами отдела исследования рака Великобритании по бесплатному телефону 0808 800 4040 с 9 до 17 часов с понедельника по пятницу.
Выживаемость по стадиям
В Великобритании нет доступных статистических данных по выживанию меланомы по стадиям.
Статистика выживаемости доступна для каждой стадии меланомы в Англии. Эти цифры относятся к мужчинам и женщинам, диагностированным в период с 2013 по 2017 год.
1 этап
Почти каждый (почти 100%) переживет рак в течение 5 или более лет после постановки диагноза.
2 этап
80 из 100 человек (80%) переживут рак в течение 5 и более лет после постановки диагноза.
3 этап
70 человек из 100 (70%) переживут рак в течение 5 или более лет после постановки диагноза.
Этап 4
Статистика выживаемости при меланоме 4 стадии не учитывает возраст людей с меланомой. Статистические данные, которые учитывают возраст (стандартизованная по возрасту статистика), недоступны.
Почти 30 из 100 человек (почти 30%) переживают рак в течение 5 или более лет после постановки диагноза.
Выживаемость рака по стадиям на момент диагностики для Англии, 2019
Управление национальной статистики
Эти цифры относятся к людям, диагностированным в Англии в период с 2013 по 2017 год.
Эти статистические данные относятся к чистой выживаемости. Чистая выживаемость оценивает количество людей, переживших рак, а не количество людей, у которых диагностирован рак, которые еще живы. Другими словами, это выживаемость больных раком с учетом того, что некоторые люди умерли бы от других причин, если бы у них не было рака.
В статистике выжившей меланомы 4 стадии не учитывается возраст людей с меланомой 4 стадии. Статистические данные, которые учитывают возраст (стандартизованная по возрасту статистика), недоступны.
Без стандартизации по возрасту на различия в выживаемости между 4 группами стадий может влиять возраст людей в каждой группе стадий в дополнение к их прогрессированию или лечению.
Мы не должны использовать эти нестандартизированные по возрасту цифры для сравнения выживаемости с другими группами, такими как различные типы, стадии рака или популяции из других стран.
Выживаемость при всех стадиях меланомы
Обычно для людей с меланомой в Англии:
- почти все люди (почти 100%) переживут меланому в течение 1 года или более после постановки диагноза
- Около 90 из каждых 100 человек (около 90%) переживут меланому в течение 5 или более лет после постановки диагноза
- Более 85 из каждых 100 человек (более 85%) переживут меланому в течение 10 или более лет после постановки диагноза
Выживаемость рака по стадиям на момент диагностики для Англии, 2019
Управление национальной статистики
Эти цифры относятся к людям, диагностированным в Англии в период с 2013 по 2017 год.
Эти статистические данные относятся к чистой выживаемости. Чистая выживаемость оценивает количество людей, переживших рак, а не количество людей, у которых диагностирован рак, которые еще живы. Другими словами, это выживаемость больных раком с учетом того, что некоторые люди умерли бы от других причин, если бы у них не было рака.
Что влияет на выживаемость
Ваш прогноз зависит от стадии рака, когда он был диагностирован.Это означает, насколько глубоко он врос в кожу и распространился ли он.
Выживание лучше для женщин, чем для мужчин. Мы не знаем точно, почему это так. Это может быть связано с тем, что женщины с большей вероятностью обратятся к врачу по поводу меланомы на более ранней стадии.
Возраст может повлиять на мировоззрение, и у молодых людей прогноз лучше, чем у пожилых.
На ваше мировоззрение также может повлиять расположение меланомы в организме.
Об этой статистике
Термины 1 год выживания и 5 лет не означают, что вы проживете только 1 или 5 лет.Они относятся к количеству людей, которые еще живы через 1 или 5 лет после того, как им поставили диагноз рака.
Многие люди с меланомой живут намного дольше, чем год или 5 лет.
Дополнительная статистика
Для получения более подробной информации о выживаемости и другой статистике меланомы перейдите в раздел «Статистика рака».
Стадия и прогноз меланомы
Если результаты анализа покажут, что у вас меланома, ваш врач определит стадию рака.Этап описывает, насколько далеко распространился рак. Определение стадии меланомы помогает вашей медицинской бригаде решить, какое лечение лучше всего для вас.
Ожидаемый результат вашего заболевания называется прогнозом, но это всего лишь прогноз, и некоторые люди не считают его полезным или даже предпочитают не знать.
Подробнее о:
Стадия меланомы
Отчет о патологии и результаты любых других анализов покажут, есть ли у вас меланома и распространилась ли она на другие части тела.Это называется стадированием и помогает вашей команде порекомендовать вам наиболее подходящее лечение.
Меланоме будет присвоена общая стадия от 0 до 4 (обычно обозначается римскими цифрами как 0, I, II, III или IV).
Стадии меланомы
| стадия 0 (in situ) | Меланома ограничена верхним, внешним слоем кожи. | ранняя или локализованная меланома |
| стадия 1 | Меланома не вышла за пределы первичного очага и имеет толщину менее 1 мм с изъязвлением или без него или толщиной 1-2 мм без изъязвления. | ранняя или локализованная меланома |
| стадия 2 | Меланома не вышла за пределы первичного очага и имеет толщину 1-2 мм и изъязвлена, или более 2 мм толщиной с изъязвлением или без него. | ранняя или локализованная меланома |
| стадия 3 | Меланома распространилась на лимфатические узлы вблизи первичного очага, на близлежащую кожу или на ткани под кожей (подкожно). | региональная меланома |
| стадия 4 | Меланома распространилась на отдаленные участки кожи и / или другие части тела, такие как легкие, печень, мозг, кости или удаленные лимфатические узлы. | продвинутая или метастатическая меланома |
Тестирование генных мутаций
Если меланома распространилась (стадия 3 или 4), специальные тесты могут помочь определить, есть ли у вас конкретное изменение (мутация) гена, которое может вызывать размножение и рост раковых клеток. Эти генетические мутации происходят из-за изменений в раковых клетках — это не то же самое, что гены, передаваемые через семьи.
Около 40% людей с меланомой имеют мутацию в гене BRAF и около 15% имеют мутацию в гене NRAS.C-KIT — редкая мутация, поражающая менее 4% людей с меланомой.
Можно провести генетические тесты на образце, удаленном во время операции. Результаты теста помогут врачам решить, может ли им быть полезна иммунотерапия или таргетная терапия.
Прогноз
Прогноз означает ожидаемый исход болезни. Вы можете обсудить свой прогноз и варианты лечения со своим врачом, но никто не может предсказать точное течение болезни.Вместо этого ваш врач может обсудить любые проблемы, которые могут у вас возникнуть.
Меланома наиболее эффективно лечится на ранних стадиях, когда она все еще ограничивается верхним слоем кожи (эпидермисом). Чем глубже меланома прорастает в нижний слой кожи (дерму), тем выше риск ее распространения на близлежащие лимфатические узлы или другие органы.
В последние годы клинические испытания привели к появлению новых лекарственных препаратов, которые продолжают улучшать прогноз для людей с меланомой, которая распространилась из первичного очага (прогрессирующая или метастатическая меланома).
Слушайте наши подкасты о принятии решений о лечении и борьбе с диагнозом рака
Время, характер, выживаемость и влияющие факторы
Метастатическая меланома (ММ) — это смертельное заболевание с быстрым системным распространением. Это исследование было проведено для изучения метастатического поведения, времени, закономерностей, выживаемости и влияющих факторов на ММ. Ретроспективно обследовано 214 пациентов с ММ. Дистанционные метастазы (82%) были наиболее частыми у пациентов с исходными метастазами.Средняя выживаемость и годовая выживаемость пациентов с исходной ММ составляли 10 месяцев и 41% соответственно. Среднее время метастазирования у пациентов с локализованным заболеванием составило 28 месяцев. Сроки появления метастазов варьировались минимально; однако время появления метастазов в отдаленные органы сильно различается. Для первого метастатического пути более половины первичных метастазов были M1A (57%). Эти результаты контрастировали с результатами по сравнению с результатами с метастатическим диагнозом (<0,001).Средняя выживаемость и годовая выживаемость всех пациентов составили 12 месяцев и 49% соответственно. Результат был выше при M1A, чем при висцеральных метастазах (<0,001). В заключение, тот факт, что более половины всех рецидивов / метастазов произошли в течение 3 лет, побуждает нас сконцентрировать последующее наблюдение в ранние периоды времени после постановки диагноза. Поскольку клиническое поведение ММ изменчиво, следует выделить факторы выживаемости, состоящие из локализации и количества метастазов.
1. Введение
На протяжении нескольких десятилетий заболеваемость меланомой неуклонно росла, поскольку показатели заболеваемости увеличивались в среднем от 3 до 8% в год и продолжают расти в настоящее время.По оценкам, на меланому приходилось 5% и 4% случаев рака у мужчин и женщин в 2009 году, и это была пятая и шестая по распространенности разновидность рака у мужчин и женщин, соответственно [1]. В настоящее время в США риск для жизни составляет один из 39 мужчин и один из 58 женщин.
Меланома — агрессивное и высокометастатическое заболевание. Метастатическая меланома — это смертельное заболевание с быстрым системным распространением. Пятилетняя выживаемость составляет менее 15% у пациентов с метастатическим поражением.В то время как меньшинство пациентов, которые составляют 4% от вновь диагностированных пациентов с меланомой [1], имеют отдаленные метастазы при первоначальном диагнозе, у большинства пациентов с ранней стадией первоначально в конечном итоге развиваются метастазы как следствие прогрессирования заболевания. Примерно у одной трети всех пациентов с меланомой возникают рецидивы заболевания [2]. Хотя могут быть задействованы почти все органы, наиболее частыми мишенями являются печень, кости и мозг. Несмотря на недавние достижения в понимании онкогенных механизмов и терапевтических вмешательств, средняя выживаемость у пациентов с метастатическим заболеванием не превышает 12 месяцев.
Несмотря на то, что факторы, предсказывающие рецидив, были хорошо описаны, лишь несколько исследований изучали естественное течение меланомы, включая факторы, которые определяют и влияют на тип, характер и время рецидива / метастазов меланомы [2–6]. . В этом ретроспективном исследовании мы проанализировали время метастазирования, паттерны и факторы, влияющие на метастазирование и выживаемость у пациентов с метастатической меланомой.
2. Материалы и методы
Двести четырнадцать пациентов с гистологически подтвержденной меланомой, пролеченных в нашей клинике с метастатическим поражением в период с 1997 по 2009 год, были обследованы ретроспективно; У 66 пациентов изначально были метастазы, а у 148 пациентов с ранней стадией метастазы развились во время лечения или последующего наблюдения.
Все пациенты были оценены и распределены по этапам при первом посещении на основе анамнеза, физического осмотра, общего анализа крови, биохимического анализа сыворотки, рентгенографии грудной клетки и компьютерной томографии, КТ или МРТ черепа, сканирования всего тела и КТ брюшной полости или УЗИ (УЗИ). Стандартный протокол последующего наблюдения применялся ко всем пациентам.
Время до метастазирования определялось как период времени от даты гистологического диагноза до момента появления метастазов. Общая выживаемость определялась как время, прошедшее между моментом гистологического диагноза и датой смерти или последним контрольным визитом.Период от даты рецидива до смерти или последнего дня наблюдения был назван выживаемостью после рецидива.
𝜒2 испытаний были выполнены для проверки разности частот. Значения общей и пострецидивной выживаемости анализировали методом Каплана-Мейера. Одномерный анализ проводился с помощью лог-ранговых тестов. Статистические различия считались достоверными при 𝑃 <0,05.
3. Результаты
Средний возраст 214 пациентов составлял 50 лет (диапазон: от 22 до 86), преобладали мужчины, 62% пациентов составляли мужчины.Характеристики пациентов приведены в таблице 1. У шестидесяти шести пациентов изначально были метастатические заболевания, а у 148 пациентов во время последующего наблюдения на ранних стадиях развились метастазы. Распределение метастазов показано в таблице 2.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.1. Метастазы при обращении
Всего у 66 пациентов (31% от всех пациентов) на момент обращения был диагностирован метастаз.
Характеристики пациентов показаны в Таблице 1. Средний возраст составлял 50 лет, две трети пациентов составляли мужчины, и их первичные поражения располагались в большей степени аксиально (56%). Распределение клинико-патологических форм (узловая и не узловая) и толщины по Бреслоу (меньше по сравнению с более чем 4 мм) было идентичным.
Чуть более половины (56%) пациентов имели единичные метастазы (таблица 2).Дистанционные метастазы, 82% в сумме, в сочетании с 67% для M1C и 15% для M1B, были наиболее частыми для пациентов с исходными метастазами, а отдаленные кожные, подкожные или узловые метастазы (M1A) были наименее распространенными (18%). Что касается поражения отдаленного органа, отличного от легкого (M1C), наиболее частым участком была печень (48%), за которой следовали мозг (29%) и кость (23%).
Распределение метастатического поведения, такое как количество и место метастазов, не отличалось в зависимости от параметров опухолей и пациентов.
Средняя выживаемость и годовая выживаемость пациентов с исходными метастазами были определены как 10 месяцев и 41%, соответственно (рис. 1). Выживаемость у пациентов с единичными метастазами была выше, чем у пациентов с множественными метастазами (медиана 12 против 7 месяцев, соответственно, = 0,07). Аналогичным образом, как статистически незначимые, пациенты с M1A имели более высокий уровень выживаемости, а пациенты с M1C имели более низкие показатели выживаемости (= 0,2). Однако не было никакой разницы в распределении поражения висцеральных органов по отношению к метастазам в органах (= 0.8).
3.2. Метастазы во время наблюдения
У 148 пациентов с меланомой кожи, диагностированной на стадии первичной опухоли без обнаруживаемых метастазов, впоследствии развились метастазы. Характеристики пациентов показаны в таблице 1. Что касается параметров пациента и заболевания, не было обнаружено различий между пациентами, у которых были метастазы при постановке диагноза, и этими пациентами.
Среднее время метастазирования для 148 пациентов с локализованным заболеванием, у которых развились метастазы во время наблюдения, составило 28 месяцев (рис. 2).Сроки появления метастазов по метастатической стадии M1 варьировали минимально. Таким образом, среднее время до метастазов составляло 28, 27 и 28 месяцев для пациентов с M1A, M1B и M1C соответственно. Точно так же нет разницы во времени возникновения метастазов между единичными и множественными метастазами. Однако время до метастазов для дистальных органов, отличных от легкого, сильно различается: более длительное время для метастазов в печень, более короткое время для метастазов в мозг и равные значения для метастазов в кости.
Две трети пациентов имели единичное метастатическое заболевание (Таблица 2). Первый метастатический путь по отношению к месту первичной опухоли показал, что более половины первичных метастазов были отдаленными кожными, подкожными или узловыми метастазами (M1A) (57%), за которыми следовали отдаленные метастазы, кроме легких (M1C) (30%). ) и метастазы в легкие (M1B) (13%). Эти результаты контрастировали с результатами по сравнению с результатами с метастатическим диагнозом (<0,001). Процент поражения печени (42%) и костей (37%) был идентичным и превышал церебральный метастаз (21%).При сравнении с группой, содержащей пациентов с метастазами, диагностированными при обращении, различий не обнаружено.
Средняя выживаемость и годовая выживаемость всех пациентов составляли 12 месяцев и 49% соответственно (рис. 3). Метастазы в один орган показали значительное преимущество в выживаемости по сравнению с множественными метастазами (в среднем 20 месяцев по сравнению с 6 месяцами, соответственно, <0,001). Аналогичным образом, общая выживаемость была значительно выше у M1A, чем у M1B и M1C (<0,001). Однако, в противоположность этому, не было различий между удаленными органами в отношении места поражения органов.
3.3. Вторичные метастазы
В нашем исследовании у 72 из 214 (34%) пациентов с метастатической меланомой дважды за время наблюдения развились метастазы. Что касается пола и возраста пациентов, различий между пациентами не было. Интересно, что пациенты с аксиальной локализацией первичной меланомы (92%) обращались чаще, чем пациенты с участками конечностей (<0,001).
Среднее время до развития вторых метастазов от момента появления первых метастазов составляло 11 месяцев (Рисунок 4).Сроки появления метастазов в зависимости от метастатической стадии M1 сильно различались. Таким образом, среднее время до развития составляло 20 и 21 месяц для M1A и M1B, соответственно, а для M1C это время было намного меньше (9 месяцев). Однако, напротив, не было различий по времени появления среди органов M1C.
Когда мы смотрим на возникновение от первых метастазов ко вторым метастазам, больше преобразований произошло между M1A в M1C (32%), M1A в M1A (21%), M1B в M1C, (17%) и M1C в M1C (15%) пациентов (таблица 3).Развитие M1C заметно произошло в результате 51% для M1A, 86% для M1B и 85% для M1C.
| ||||||||||||||||||||||||||||||
Сроки появления метастазов в соответствии с метастатической трансформацией были разными. Среднее время до развития вторичных метастазов составляло 20 и 21 месяц для M1A – M1A и M1A – M1B, соответственно, и 7 месяцев для M1C – M1C (рис. 5).
Как и в предыдущих группах, почти у двух третей пациентов метастатическое распространение было единичным метастатическим участком (таблица 2). Как и у пациентов с метастазами на момент обращения, 75% пациентов, у которых развились клинические метастазы, вторично представили отдаленные метастазы, в сочетании с 64% для M1C плюс 11% для M1B и отдаленных кожных, подкожных или узловых метастазов (M1A) развились только в четверть пациентов (таблица 2). Другими словами, эти результаты противоречили данным по метастазам во время наблюдения (<0.001) и аналогичны данным о метастазах при предъявлении (рис. 6).
У 44% пациентов в ходе наблюдения развились вторые метастазы в головной мозг. У оставшейся половины пациентов выполнено поражение костей (31%) и печени (25%) (Таблица 2). Эти значения статистически отличаются как от метастазов при поступлении (= 0,05), так и от метастазов во время наблюдения (= 0,04) (рис. 7). В то время как костные метастазы были равномерно распределены по полу, печень (64% против 36%, = 0.02) и головного мозга (79% против 21%, = 0,04) метастазов чаще было обнаружено у женщин и мужчин соответственно. Никакой другой корреляции между факторами пациента / заболевания и количеством / местом метастазов обнаружено не было.
4. Обсуждение
Пациенты с метастатической меланомой обычно имеют плохой прогноз; выживаемость ограничена и обычно измеряется месяцами, а не годами. В целом продолжительность выживания составляет менее года, в среднем от 6 до 8 месяцев. Годовая выживаемость составляет 45%, а менее 10% проживут 5 лет и более.Многофакторный анализ прогностических факторов выявил несколько независимых факторов, которые предсказывают выживаемость в этой группе с плохим прогнозом, включая место первых метастазов, количество метастазов и продолжительность ремиссии [2–4].
Место отдаленных метастазов является важным независимым предиктором выживаемости у пациентов с метастатическим заболеванием [3, 4]. В анализе базы данных меланомы AJCC 2002 года была обнаружена наибольшая разница в выживаемости, показывающая, что пациенты с локорегиональными, удаленными узловыми метастазами и метастазами мягких тканей имеют лучшую выживаемость, чем пациенты с висцеральными метастазами [3, 7].Кроме того, пациенты, у которых легкие были единственным местом висцеральных метастазов, имели лучшее время выживания в течение 1 года по сравнению с пациентами с метастазами в других висцеральных участках. В недавнем анализе базы данных меланомы AJCC разделение пациентов на три группы по локализации заболевания привело к наибольшему увеличению средней выживаемости [3, 8]. Пациенты с метастазами меланомы во внутренние органы, отличные от легких (M1C), имели медианную выживаемость 7 месяцев, пациенты с метастазами в легких — 12 месяцев, а пациенты с метастазами в невисцеральные участки (т.(например, кожа, подкожная клетчатка и удаленные лимфатические узлы) средняя выживаемость составляла 18 месяцев. Как правило, пациенты, у которых есть висцеральные метастазы не в легкие, например, в печень, мозг или кость, плохо себя чувствуют, их средняя выживаемость составляет от 3 до 6 месяцев.
Пациенты с одним удаленным местом метастазирования имеют значительно лучший результат по сравнению с пациентами с двумя или более удаленными участками [3]. Количество метастазов было наиболее значимым прогностическим фактором у пациентов с отдаленными метастазами [9].В этом исследовании пациенты с одним, двумя, тремя или более участками отдаленных метастазов имели среднюю продолжительность выживания 7, 4 и 2 месяцев соответственно. Годовая выживаемость составила 36% для пациентов с одним метастатическим участком, 13% для пациентов с двумя участками и менее 1% для пациентов с тремя или более участками. В другом исследовании количество метастазов, один против нескольких, было самым сильным независимым предиктором выживаемости; среднее время выживания для групп составляло 23 месяца и 8 месяцев соответственно [10].В предварительном анализе совместной базы данных по меланоме на стадии IV 2008 года количество метастатических участков также было связано с выживаемостью как при одномерном, так и при многомерном анализах [8]. Однако, в отличие от этих исследований, количество метастатических участков не было значимым независимым прогностическим фактором при многомерном анализе исследований [11]. Это может указывать на то, что определенные участки метастазов оказывают доминирующее негативное влияние на выживаемость. Пациенты, у которых исходным местом метастазирования была печень или мозг, имели медианную выживаемость всего 4 месяца по сравнению с пациентами, у которых исходными участками были кожа и / или лимфатические узлы, у которых медиана выживаемости составляла 15 месяцев [4, 11].
Немногие пациенты с впервые диагностированной меланомой имеют клинически очевидные отдаленные метастазы при первоначальном диагнозе [1, 4]. У большинства пациентов с метастазами, которые поступают на раннюю стадию, в конечном итоге метастатическое заболевание развивается как следствие прогрессирования заболевания. Почти у трети всех пациентов с меланомой возникают рецидивы заболевания [2]. Для большинства пациентов без отдаленных метастазов время рецидива / метастазирования обратно пропорционально стадии опухоли на момент обращения.Для пациентов с более толстыми опухолями риск рецидива наиболее высок в первый год после лечения и неуклонно снижается с течением времени [2, 4]. Большинство рецидивов (от 55% до 79%) становятся очевидными через 2 года, тогда как от 65% до 85% проявляются через 3 года после первоначального диагноза первичной опухоли. Кроме того, у пациентов с изъязвленными опухолями интервал без признаков заболевания значительно короче [2, 4]. Как правило, у пациентов с метастазами в лимфатические узлы III стадии рецидивы возникают раньше, чем у пациентов с отрицательными лимфатическими узлами.Кроме того, возраст постановки диагноза также может влиять на время появления отдаленных метастазов, то есть у пациентов старше 50 лет рецидивы рецидивируют раньше, чем у более молодых. Безрецидивный интервал до начала отдаленных метастазов был значимым прогностическим фактором при многомерном анализе исследований [9, 11]. Стадия заболевания, предшествующая отдаленным метастазам, также была определена как важный прогностический фактор [11]. Для пациентов, у которых болезнь прогрессировала непосредственно от стадии I или II, безрецидивный интервал в 34 месяца или более был связан с более продолжительной выживаемостью, тогда как для пациентов с меланомой III стадии в анамнезе период без заболевания составлял 18 месяцев или более. связано с длительным выживанием.
Меланома хорошо известна своей способностью метастазировать практически в любой орган или ткань, включая некоторые участки, редко встречающиеся с другими солидными опухолями [4]. Тем не менее, некоторые участки с большей вероятностью могут содержать начальные отдаленные метастазы. Начальными участками отдаленных метастазов чаще всего являются кожа, подкожная клетчатка и лимфатические узлы, которые в различных исследованиях встречались у 42-59% пациентов. Висцеральные метастазы были начальными участками рецидива примерно у 25% всех пациентов с метастатической меланомой.Наиболее частыми местами висцеральных метастазов были легкие (18–36%), мозг (12–20%), печень (14–20%) и кости (11–17%).
В заключение, необходимо наблюдение за пациентами с меланомой в течение всей жизни, особенно в течение первых трех лет, поскольку ожидаемое излечение редко достигается после хирургического удаления, а также после адъювантного лечения. Тот факт, что более половины всех рецидивов / метастазов произошли в течение 3 лет, побуждает нас сосредоточить последующее наблюдение в ранние периоды времени после постановки диагноза.В целом прогноз пациентов с метастатической меланомой плохой; однако, поскольку клиническое поведение метастатической меланомы варьируется, следует выделить важные факторы выживаемости, состоящие из места метастазирования и количества метастатических участков.
Конфликт интересов
Авторы не заявляют о конфликте интересов.
Прогноз меланомы
Прогноз для пациента с меланомой зависит от ряда различных характеристик опухоли, включая тип и стадию прогрессирования.
Изображение предоставлено: Nasekomoe / Shutterstock.com
Если меланома может быть диагностирована на ранней стадии, прогноз очень высокий с выживаемостью, близкой к 100%, но прогноз значительно ухудшается, если диагноз не ставится до более поздних стадий прогрессирования. По этой причине стоит поощрять регулярные проверки кожи, чтобы улучшить методы раннего вмешательства.
Факторы прогноза
Существуют различные факторы, которые могут повлиять на прогноз человека с меланомой.
- Глубина Бреслоу (толщина опухоли)
- Уровень Кларка (глубина структуры кожи)
- Тип меланомы
- Наличие язвы
- Поражение лимфатических узлов
- Наличие лимфоцитов, инфильтрирующих опухоль
- Место поражения
- Спутниковые поражения
- Региональные или отдаленные метастазы
Если меланома распространилась на близлежащие лимфатические узлы, количество и размер пораженных узлов являются важными показателями тяжести заболевания.В целом, местные рецидивы развиваются и растут аналогично первичной опухоли. Однако, если они расположены в месте широкого местного иссечения, рост может значительно измениться.
Определенные типы меланомы связаны с лучшим или худшим прогнозом, который обычно связан с типичной толщиной этого типа. Менее инвазивные меланомы, как правило, имеют лучший прогноз, чем глубокие меланомы, даже если есть поражение лимфатических узлов.
Размер метастазов меняет прогноз, при этом микрометастазы связаны с лучшим прогнозом, чем пациенты с макрометастазами.Местоположение метастазов также имеет значение, с лучшим прогнозом для поражений кожи или легких и худшим прогнозом при поражении мозга, костей и печени.
Стадия меланомы
Существует несколько различных стадий меланомы в зависимости от прогрессирования заболевания. Ниже приводится расчетная выживаемость в течение пяти лет после постановки диагноза:
- Стадия 0: выживаемость 99,9%
- Стадия I: выживаемость 89-95% (инвазивная меланома)
- Первичная опухоль менее 1.0 мм толщиной с митозом или изъязвлением
- Первичная опухоль толщиной 1,0-2,0 мм без изъязвления
- Стадия II: выживаемость 45-79% (меланома высокого риска)
- Первичная опухоль толщиной 1,0-2,0 мм с изъязвлением
- Первичная опухоль толщиной 2,0-4,0 мм, с изъязвлением или без него
- Первичная опухоль толщиной более 4,0 мм с изъязвлением или без него
- Стадия III: выживаемость 24-70% (регионарный метастаз)
- 1-4 положительное поражение лимфатических узлов
- Регионарные метастазы в коже
- Стадия IV: выживаемость 7-19% (отдаленные метастазы)
- Отдаленные метастазы на коже с нормальным уровнем ЛДГ
- Метастазы в легкие с нормальной ЛДГ
- Любые отдаленные метастазы с повышенным уровнем ЛДГ
Очевидно, что 5-летняя выживаемость ниже при более поздних стадиях заболевания, что определяется стадией диагностики.На стадии IV болезни, когда имеются отдаленные метастазы, рак обычно считается неизлечимым, и средняя выживаемость составляет менее одного раза в год, хотя некоторые пациенты живут несколько лет. В этом случае целью лечения является продление и улучшение качества жизни с применением паллиативной помощи.
Список литературы
Дополнительная литература
лечение меланомы — NHS
Хирургия — основное лечение меланомы.
Если у вас меланома кожи, о вас позаботится группа специалистов, в которую должны входить кожный специалист (дерматолог), пластический хирург, специалист по лучевой терапии и химиотерапии (онколог), специалист по заболеваниям тканей ( патолог) и медсестра-специалист.
Помогая вам выбрать лечение, команда учтет:
- тип рака, который у вас есть
- стадию рака (размер и степень распространения)
- ваше общее состояние здоровья
ваше Лечебная команда порекомендует то, что, по их мнению, является лучшим вариантом лечения, но окончательное решение будет за вами.
Перед тем, как отправиться в больницу для обсуждения вариантов лечения, вам может быть полезно составить список вопросов, которые следует задать специалисту.
Например, вы можете узнать о преимуществах и недостатках конкретных методов лечения.
Узнайте больше о вопросах, которые следует задать своему врачу.
Лечение меланомы 1-2 стадии
Лечение меланомы 1 стадии включает в себя операцию по удалению меланомы и небольшого участка кожи вокруг нее.Это называется хирургическим вмешательством.
Хирургическое иссечение обычно выполняется под местной анестезией, что означает, что вы будете бодрствовать, но область вокруг меланомы будет немеющей, поэтому вы не почувствуете боли. В некоторых случаях используется общий наркоз, что означает, что вы будете без сознания во время процедуры.
Если после хирургического иссечения может остаться значительный рубец, его можно провести в сочетании с кожным трансплантатом. Тем не менее, кожные лоскуты сейчас используются чаще, потому что рубцы обычно менее заметны, чем шрамы от кожного трансплантата.
Подробнее о лоскутной хирургии.
В большинстве случаев после удаления меланомы вероятность ее возвращения мала, и дальнейшее лечение не требуется. Большинство людей (от 80 до 90%) находятся под наблюдением от 1 до 5 лет, а затем выписываются без дальнейших проблем.
Биопсия сторожевого лимфатического узла
Биопсия сторожевого лимфатического узла — это процедура для проверки распространения рака.
Может предлагаться людям с меланомой 1B — 2C стадии. Это делается одновременно с хирургическим удалением.
Вы решите вместе с врачом, делать ли биопсию сигнального лимфатического узла.
Если вы решили пройти процедуру, и результаты не показывают распространения на близлежащие лимфатические узлы, маловероятно, что у вас возникнут дальнейшие проблемы с этой меланомой.
Если результаты подтвердят, что меланома распространилась на близлежащие узлы, ваш специалист обсудит с вами, требуется ли дальнейшая операция.
Дополнительная операция включает удаление оставшихся узлов, известное как лимфодиссекция или завершающая лимфаденэктомия.
Лечение меланомы 3 стадии
Если меланома распространилась на близлежащие лимфатические узлы (меланома 3 стадии), для их удаления может потребоваться дополнительная операция.
Меланома 3 стадии может быть диагностирована с помощью биопсии сторожевого узла, или вы или член вашей лечебной бригады могли почувствовать уплотнение в ваших лимфатических узлах.
Диагноз меланомы обычно подтверждается с помощью пункционной биопсии (тонкоигольной аспирации).
Удаление пораженных лимфатических узлов проводится под общим наркозом.
Процедура, называемая лимфодиссекцией, может нарушить работу лимфатической системы, что приведет к скоплению жидкости в конечностях. Это известно как лимфедема.
Cancer Research UK предоставляет дополнительную информацию об операции по удалению лимфатических узлов.
Лечение меланомы 4 стадии
Если меланома возвращается или распространяется на другие органы, это называется меланомой 4 стадии.
В прошлом излечение от меланомы 4 стадии было очень редким явлением, но новые методы лечения, такие как иммунотерапия и таргетное лечение, дают обнадеживающие результаты.
Лечение меланомы 4 стадии проводится в надежде, что оно может замедлить рост рака, уменьшить симптомы и увеличить продолжительность жизни.
Вам могут предложить операцию по удалению других меланом, которые выросли за пределы исходного участка. Вы также можете пройти другие методы лечения, чтобы облегчить симптомы, например лучевую терапию и лекарства.
Если у вас меланома на поздней стадии, вы можете отказаться от лечения, если оно вряд ли значительно продлит вашу жизнь или если у вас нет симптомов, вызывающих боль или дискомфорт.
Это полностью ваше решение, и ваша терапевтическая бригада его уважает. Если вы решите не получать лечение, вам будут предоставлены обезболивающие и уход за больными, когда они вам понадобятся. Это называется паллиативной помощью.
Иммунотерапия
Иммунотерапия используется для лечения меланомы на поздней стадии (4 стадия), и иногда ее предлагают людям с меланомой 3 стадии в рамках клинических испытаний.
В иммунотерапии используются лекарства, которые помогают иммунной системе организма находить и уничтожать клетки меланомы.
Доступно несколько различных лекарств, некоторые из которых можно использовать отдельно (монотерапия) или вместе (комбинированная терапия).
Используемые лекарства включают:
- ипилимумаб
- ниволумаб
- пембролизумаб
- талимоген лахерпарепвек
Эти лекарства часто рекомендуются людям с ранее пролеченными или нелечеными меланомами, которые распространяются или не могут быть удалены хирургическим путем.
Их вводят капельно или инъекционно каждые несколько недель.Некоторые лекарства назначаются на краткосрочной основе в течение нескольких недель. Остальные выдаются на более длительный срок.
Побочные эффекты иммунотерапевтических препаратов включают:
Целевое лечение
Примерно у каждого второго человека с меланомой есть изменение (мутация) в гене, называемом BRAF. Эта мутация заставляет клетки слишком быстро расти и делиться.
Таргетное лекарство может использоваться для нацеливания этой мутации, чтобы замедлить или остановить рост раковых клеток.
Целевые методы лечения меланомы включают:
- вемурафениб
- дабрафениб
- траметиниб
Эти лекарства могут быть рекомендованы для лечения людей с мутацией гена и агрессивным типом меланомы в одной части тела или меланома, которая распространяется.
Побочные эффекты этих лекарств могут включать:
Cancer Research UK имеет дополнительную информацию об иммунотерапии и целевом лечении меланомы.
Лучевая и химиотерапия
Вам может быть назначена лучевая терапия после операции по удалению лимфатических узлов, и ее также можно использовать для облегчения симптомов меланомы на поздней стадии. Для уничтожения раковых клеток используются контролируемые дозы радиации.
Если у вас меланома на поздней стадии, вам может быть назначено одно или несколько курсов лечения.Лучевая терапия после операции обычно состоит из 5 процедур в неделю (1 сеанс ежедневно с понедельника по пятницу) в течение нескольких недель. На выходных период отдыха.
Общие побочные эффекты, связанные с лучевой терапией, включают:
- усталость
- плохое самочувствие
- потеря аппетита
- выпадение волос
- болезненность кожи
Многие побочные эффекты можно предотвратить или контролировать с помощью рецептурных лекарств, так что сообщите свое лечение команда, если у вас возникли какие-либо проблемы.По окончании лечения побочные эффекты лучевой терапии должны постепенно уменьшаться.
В настоящее время химиотерапия редко используется для лечения меланомы. Целенаправленное лечение и иммунотерапия являются предпочтительными вариантами лечения.
Вакцины против меланомы
В настоящее время ведутся исследования по созданию вакцин от меланомы для лечения запущенной меланомы или для использования после операции у людей с высоким риском возвращения меланомы.
В настоящее время они предоставляются только в рамках клинических испытаний.
Cancer Research UK предоставляет дополнительную информацию о вакцинах от меланомы.
Последующая деятельность
После лечения у вас будут регулярные контрольные визиты, чтобы проверить:
- есть ли признаки возвращения меланомы
- меланома распространилась на ваши лимфатические узлы или другие области вашего тела
- есть признаки любой новой первичной меланомы
Ваш врач или медсестра осмотрят вас. Они спросят о вашем общем состоянии здоровья, а также о том, есть ли у вас какие-либо вопросы или опасения.
Вам могут предложить лечение, например иммунотерапию, чтобы попытаться предотвратить возвращение меланомы. Это называется адъювантным лечением.
Не так много доказательств того, что адъювантное лечение помогает предотвратить рецидив меланомы, поэтому в настоящее время оно предлагается только в рамках клинических испытаний.
Есть свидетельства того, что методы лечения контрольными точками, которые усиливают иммунный ответ организма на рак, могут использоваться в будущем, если клинические испытания подтвердят их эффективность.
Cancer Research UK может предоставить дополнительную информацию о последующих визитах.
Справка и поддержка
Иногда бывает трудно справиться с диагнозом меланома. Вы можете чувствовать себя шокированным, расстроенным, онемевшим, напуганным, неуверенным и сбитым с толку. Такие чувства естественны.
Вы можете спросить свою терапевтическую бригаду обо всем, в чем вы не уверены.
Ваша семья и друзья могут быть отличным источником поддержки. Разговор о раке и о том, как вы себя чувствуете, может помочь и вам, и членам вашей семьи справиться с ситуацией.
Некоторые люди предпочитают разговаривать с людьми вне своей семьи. Есть несколько благотворительных организаций в Великобритании, у которых есть специально обученный персонал, с которым вы можете поговорить по бесплатному телефону доверия:
Cancer Research UK также имеет раздел о жизни с меланомой.
Найдите другие службы поддержки рака поблизости от вас.
Клинические испытания
Любое новое лечение рака сначала назначается пациентам в ходе клинических испытаний.
Клинические испытания — это строгий способ тестирования новых методов лечения на людях.Пациенты находятся под тщательным наблюдением за любыми эффектами, которые лекарство оказывает на рак, а также за любыми побочными эффектами.
Многим людям с меланомой предлагается пройти клинические испытания.
Если вас попросят принять участие в клиническом исследовании, вам будет предоставлен информационный лист, и, если вы решите принять участие, вам будет предложено подписать форму согласия.
Вы можете отказаться от участия в клиническом исследовании в любое время, это не повлияет на ваше лечение.
Последняя проверка страницы: 7 февраля 2020 г.
Срок следующей проверки: 7 февраля 2023 г.
Читальный зал ASCO | При меланоме на ранней стадии не требуется интенсивное наблюдение
Критический эксперт
ИЗ читального зала ASCOРозана Гнанахоти, доктор медицины Лечащий врач гематологии-онкологии; По совместительству доцент медицины Колумбийский университет, штат Нью-Йорк; Медицинский центр Бассетт, Больница Мэри Имоджин Бассетт
Прогноз для пациентов с меланомой на ранней стадии отличный: у пациентов с меланомой 1 стадии 5-летняя выживаемость составляет 95%.Стоимость обнаружения рецидива у пациента с меланомой 1 стадии оценивается в 38 574 долларов США, при этом большая часть затрат приходится на последующие визиты. Исследование, сравнивающее стандартное последующее наблюдение и ослабленное последующее наблюдение у пациентов с меланомой 1 и II стадии, продемонстрировало минимальную задержку постановки диагноза с ослабленным последующим наблюдением. Однако гетерогенность опухоли составляет небольшой процент пациентов с меланомой на ранней стадии, имеющих метастатический рецидив и агрессивное течение. Следовательно, стратегии эпиднадзора с учетом рисков должны применяться при последующем наблюдении за пациентами с меланомой на ранней стадии.Исследование, проведенное в рамках проекта Melbourne Melanoma, определило группу рецидива меланомы I-II стадии с очень низким риском, за которой потенциально можно наблюдать менее интенсивное наблюдение. Эта группа пациентов определялась отсутствием неблагоприятных патологических признаков, таких как изъязвление, наличие митоза, уровень Кларка> 4 и лимфатическая сосудистая инвазия, а также аутоиммунное заболевание в анамнезе. Исследователи предположили, что за этими пациентами можно наблюдать менее интенсивный режим наблюдения с ежегодным наблюдением с полным осмотром кожи.
Было обнаружено, что наличие аутоиммунного заболевания и инвазии лимфатических сосудов в первичной опухоли являются независимыми предикторами рецидива, которые ранее не использовались при стратификации риска. Тест профилирования экспрессии 28 генов — еще один важный инструмент, изучаемый для стратификации риска меланомы I и II стадии высокого риска, и его можно использовать для прогнозирования риска метастазирования.
В заключение следует отметить, что для последующего наблюдения за меланомой на ранней стадии следует использовать стратегию наблюдения, основанную на оценке риска, и пациентов с очень низким риском можно наблюдать один раз в год.
Полная критика
Согласно новому исследованию, пациенты с меланомой I стадии без неблагоприятных патологических признаков имеют низкий риск рецидива и не нуждаются в интенсивном наблюдении за первичной меланомой.
«В этом исследовании используется большой проспективный набор данных, чтобы показать, что пациенты с меланомой I стадии без неблагоприятных патологических признаков — без изъязвлений, отсутствия митоза, уровня Кларка ниже 4 и отсутствия лимфоваскулярной инвазии — имеют очень низкий риск рецидив меланомы и не требует интенсивного наблюдения », — сказал MedPage Today старший автор, Дэвид Дьёрки, доктор медицинских наук, Онкологического центра Питера МакКаллума в Мельбурне, Австралия.
«Исследование определило аутоиммунное заболевание как независимый предиктор рецидива меланомы. Кроме того, наличие лимфоваскулярной инвазии в первичной опухоли было независимо связано с рецидивом. Эти факторы не отражены в системе определения стадии AJCC [Американский объединенный комитет по раку]. »
Gyorki отметил, что прогноз для пациентов с меланомой на ранней стадии в целом отличный, с 5-летней выживаемостью 95%. Однако для стадии II этот показатель составляет 68%.Плохо изученная гетерогенность опухоли означает, что даже у пациентов со стадией I болезни может развиться последующее метастатическое заболевание.
Исследователи проанализировали данные Мельбурнского проекта по меланоме, чтобы оценить, являются ли известные прогностические факторы, связанные с рецидивом, прогнозирующими в большом, проспективно собранном наборе данных. Цель состояла в том, чтобы подтвердить известные прогностические факторы рецидива и выживаемости, выявить новые предикторы рецидива и определить, у каких пациентов был низкий риск рецидива.
Исследование, опубликованное в журнале Melanoma Research в феврале 2017 года, включало 1029 пациентов с меланомой I и II стадии; У 123 пациентов развился рецидив в течение периода наблюдения в среднем 2,13 года. Многопараметрический анализ выявил изъязвление, наличие митозов, уровень Кларка, наличие лимфоваскулярной инвазии и аутоиммунное заболевание в анамнезе как факторы, независимо связанные с рецидивом.
Исследователи предполагают, что пациенты с меланомой I стадии с очень низким риском рецидива — без изъязвлений, нулевых митозов, низкого уровня Кларка, без лимфоваскулярной инвазии и, возможно, без аутоиммунных заболеваний в анамнезе — не требуют интенсивного наблюдения. и что могут потребоваться 12 ежемесячных обзоров и полные проверки кожи.
«Пациенты должны быть проинформированы о риске рецидива на основании множества патологических факторов», — сказал Гьорки. «За пациентами с аутоиммунным заболеванием следует более внимательно наблюдать из-за повышенного риска рецидива меланомы».
Большинство пациентов с диагнозом меланома имеют заболевание на ранней стадии. «Большинство этих пациентов больше не вернутся», — сказал он. «Долгосрочное наблюдение за такими пациентами должно быть сосредоточено на выявлении новых первичных форм рака и, следовательно, должно определяться факторами риска, такими как предыдущие меланомы, множественные невусы или иммуносупрессия — факторы, которые не исследовались в этом исследовании, — а не особенности индекса поражения.«
Стоимость обнаружения рецидива у пациента с меланомой I стадии оценивается в 38 574 долларов США, при этом основная часть затрат связана с последующими визитами. Моделирующее исследование 3081 пациента с меланомой I и II стадии показало, что ежегодные визиты в течение 10 лет после постановки диагноза приведут лишь к минимальной задержке постановки диагноза по сравнению с режимом из двух посещений в год в течение 5 лет и последующих ежегодных посещений.
«Наше исследование демонстрирует, что использование регулярно сообщаемых факторов, таких как глубина опухоли, наличие язвы, наличие митоза и наличие лимфоваскулярной инвазии, а также клинический анамнез аутоиммунного заболевания, обеспечивает рентабельный способ выявления когорты пациентов с очень низкими показателями. — риск повторения », — заявили исследователи.
Следующим шагом в исследовании, сказал Дьёрки, будет изучение пациентов с толстой первичной меланомой, а также с меланомой с положительным лимфоузлом, чтобы определить способы улучшения стратификации риска для этих пациентов. Стадии меланомы продолжают развиваться, чтобы включать новые прогностические маркеры, которые могут более точно разделить пациентов на тех, кто имеет очень низкий риск рецидива, и тех, кто нуждается в более агрессивном наблюдении и, следовательно, может быть кандидатом на более продвинутую адъювантную терапию.
Исследователи, изучающие тест профиля экспрессии 28 генов (GEP), недавно сообщили об отрицательной прогностической ценности 97% и положительной прогностической ценности 72% для выявления меланомы стадии I и стадии II с 5-летней выживаемостью без метастазов. Инструмент GEP также точно предсказал риск метастазирования у пациентов с отрицательным результатом биопсии сторожевого лимфатического узла. По его словам, профилирование экспрессии генов в первичной и рецидивирующей опухолевой ткани для поиска рецидивов у пациентов с низким риском является многообещающим, но является дорогостоящим методом стратификации риска.
На данный момент онкологам необходимо знать, что «пациенты с аутоиммунным заболеванием с диагнозом меланома имеют более высокий риск рецидива. При стратификации риска следует учитывать полный отчет о патологии, включая изъязвление, скорость митоза и лимфоваскулярную инвазию».
Гёрки не разглашал.
Читать статью полностью
Интенсивное наблюдение не требуется при меланоме на ранней стадии
Посмотреть и скачать статью в формате PDFМеланома кожи головы и шеи: анализ 5-летней выживаемости в сербском университетском центре | Всемирный журнал хирургической онкологии
Weinstock MA. Эпидемиология, этиология и борьба с меланомой. Med Health R I. 2001; 84 (7): 234–6.
CAS PubMed Google Scholar
Национальный институт рака. Эпиднадзор, эпидемиология и конечные результаты. Доступно в Интернете: https://seer.cancer.gov/statfacts/html/melan.html (по состоянию на 8 октября 2020 г.).
Uslu U, Schuler G, Breuninger H. Факторы, влияющие на прогрессирование заболевания у пациентов с меланомой головы и шеи.Anticancer Res. 2017; 37 (7): 3811–6.
PubMed Google Scholar
Шоу Дж. Х. Ф., Фэй М. Ведение меланомы головы и шеи, лечение метастатической меланомы. Мортон Р., редактор. InTech; 2011 г. Доступно по адресу: http://www.intechopen.com/books/treatment-of-metastatic-melanoma/management-of-head-andneckmelanoma. ISBN: 978-953-307-574-7.
Balch CM, Gershenwald JE, Soong SJ, et al. Окончательная версия стадии и классификации меланомы AJCC 2009 г.J Clin Oncol. 2009. 27 (36): 6199–206.
Артикул Google Scholar
Retsas S, Henry K, Mohammed MQ, MacRae K. Прогностические факторы кожной меланомы и новая система стадий, предложенная Американским объединенным комитетом по раку (AJCC): проверка на когорте из 1284 пациентов. Eur J Cancer. 2002. 38 (4): 511–6.
CAS Статья Google Scholar
Аль-Курайши З., Хассан М., Шривастав С. и др.Риск и выживаемость пациентов с меланомой кожи головы и шеи: национальная перспектива. Онкология. 2017; 93 (1): 18–28.
Артикул Google Scholar
Ow TJ, Grethlein SJ, Schmalbach CE. Комитет по образованию Американского общества головы и шеи (AHNS). Вы знаете свои правила? Диагностика и лечение меланомы кожи головы и шеи. Голова Шея. 2018; 40 (5): 875–85.
Артикул Google Scholar
Gershenwald JE, Scolyer RA. Стадия меланомы: 8-е издание Американского объединенного комитета по раку (AJCC) и далее. Энн Сург Онкол. 2018; 25 (8): 2105–10.
Артикул Google Scholar
Руководства по организации стадий AJCC. Доступно в Интернете: http://cancerstaging.org/references-tools/deskreferences/Documents/AJCC%207th%20Ed%20Cancer%20Staging%20Manual.pdf (по состоянию на 8 октября 2020 г.).
Яо К., Балч Дж., Винчестер Диджей.Многопрофильное лечение первичной меланомы. Surg Clin North Am. 2009; 89 (1): 267 – xi.
Артикул Google Scholar
Балч С.М., Урист М.М., Каракусис С.П. и др. Эффективность хирургических полей шириной 2 см при меланомах средней толщины (от 1 до 4 мм). Результаты мультиинституционального рандомизированного хирургического исследования. Ann Surg. 1993. 218 (3): 262–9.
CAS Статья Google Scholar
Möhrle M, Schippert W, Rassner G, Garbe C, Breuninger H. Имеет ли биопсия сторожевого лимфатического узла терапевтическое значение для лечения меланомы? Дерматология. 2004. 209: 5–13.
Артикул Google Scholar
Medalie N, Ackermann AB. Биопсия сторожевого узла не приносит пользы пациентам, у которых первичная кожная меланома метастазировала в лимфатический узел, и поэтому от нее следует сейчас отказаться. Br J Dermatol. 2004. 151: 298–307.
CAS Статья Google Scholar
Balch CM, Cascinelli N. Биопсия сторожевого узла при меланоме. N Engl J Med. 2006; 355: 1370–1.
CAS Статья Google Scholar
Tanis PJ, Nieweg OE, van den Brekel MW, Balm AJ. Дилемма меланомы головы и шеи с клинически отрицательными лимфоузлами: результат политики «смотри и подожди», выборная лимфодиссекция и биопсия сторожевого узла — систематический обзор. Голова Шея. 2008. 30: 380–9.
Артикул Google Scholar
Национальная всеобъемлющая онкологическая сеть. Рекомендации для пациентов: меланома. Доступно в Интернете: https://www.nccn.org/patients/guidelines/content/PDF/melanoma-patient.pdf (по состоянию на 8 октября 2020 г.).
О’Брайен С.Дж., Макнил Э.Б., МакМахон Д.Д., Патак И., Лауэр К.С. Частота вовлечения шейных узлов в метастатические кожные злокачественные новообразования с поражением околоушной железы. Голова Шея. 2001; 23: 744–8.
Артикул Google Scholar
Чанг С., Пинна А., Иоанну К., Ющик К., Шеннон К., Клиффорд А., Урен Р., Кларк Дж. Р. Оценка лимфатических узлов второго уровня при меланоме и значение степени выборной диссекции шеи при метастатическом поражении кожи околоушной железы. Голова Шея. 2013. 35 (2): 205–8.
Артикул Google Scholar
Lachiewicz AM, Berwick M, Wiggins CL, Thomas NE. Различия в выживаемости между пациентами с меланомой кожи головы или шеи и пациентами с меланомой других локализаций в программе «Наблюдение, эпидемиология и конечные результаты» (SEER).Arch Dermatol. 2008. 144 (4): 515–21.
Артикул Google Scholar
Эль-Шаруни М.А., Виткамп А.Дж., Сигурдссон В., ван Дист П.Дж., Лоувман М.В.Дж., Кукутч Н.А. Секс имеет значение: у мужчин с меланомой прогноз хуже, чем у женщин. J Eur Acad Dermatol Venereol. 2019; 33 (11): 2062–7.
Артикул Google Scholar
Теракедис Б.Э., Анкер С.Дж., Личман С.А. и др. Паттерны неудач и предикторы исхода при кожной злокачественной меланоме волосистой части головы.J Am Acad Dermatol. 2014; 70 (3): 435–42.
Артикул Google Scholar
Леонг С.П., Аккортт Н.А., Эсснер Р. и др. Влияние статуса сторожевого узла и других факторов риска на клинические исходы пациентов с меланомой головы и шеи. Arch Otolaryngol Head Neck Surg. 2006. 132 (4): 370–3.
Артикул Google Scholar
О’Брайен С.Дж., Коутс А.С., Петерсен-Шефер К. и др.Опыт лечения 998 меланом кожи головы и шеи более 30 лет. Am J Surg. 1991. 162 (4): 310–4.
Артикул Google Scholar
Шумате С.Р., Карлсон Г.В., Джакко Г.Г. и др. Прогностические последствия локализации меланомы волосистой части головы. Am J Surg. 1991. 162 (4): 315–9.
CAS Статья Google Scholar
де Джорджи В., Россари С., Гори А. и др.Прогностическое влияние анатомических участков «меланомы головы и шеи»: кожа головы в сравнении с лицом и шеей. Melanoma Res. 2012. 22 (5): 402–5.
Артикул Google Scholar
Парретт Б.М., Кашани-Сабет М., Сингер М.И. и др. Долгосрочный прогноз и значение сторожевого лимфатического узла при меланоме головы и шеи. Otolaryngol Head Neck Surg. 2012. 147 (4): 699–706.
Артикул Google Scholar
Cappello ZJ, Augenstein AC, Potts KL, et al. Состояние сторожевых лимфатических узлов является наиболее важным прогностическим фактором у пациентов с меланомой волосистой части головы. Ларингоскоп. 2013. 123 (6): 1411–5.
Артикул Google Scholar
Озао-Чой Дж., Нельсон Д. В., Хайлз Дж., Стерн С., Юн Дж. Л., Сим М. С., Фарис М.Б. Прогностическое значение локализации волосистой части головы при первичной меланоме головы и шеи. J Surg Oncol. 2017; 116 (3): 337–43.
Артикул Google Scholar
Xie C, Pan Y, McLean C, Mar V, Wolfe R, Kelly J. Влияние расположения кожи головы на выживаемость при меланоме головы и шеи: ретроспективное когортное исследование. J Am Acad Dermatol. 2017; 76 (3): 494–498.e2.
Артикул Google Scholar
Den Hondt M, Starr MW, Millett MC, Smyth J, Scolyer RA, Shannon KF, Thompson JF, Ch’ng S. Хирургическое лечение шеи у пациентов с метастатической меланомой в околоушных лимфатических узлах. J Surg Oncol. 2019; 120 (8): 1462–9.
Артикул Google Scholar
Mack LA, McKinnon JG. Споры в лечении метастатической меланомы в регионарные лимфатические бассейны. J Surg Oncol. 2004; 86: 189–99.
Артикул Google Scholar
White N, Yap LH, Srivastava S. Лимфаденэктомия при меланоме шеи N1 клинически: радикальная, модифицированная радикальная или селективная? J Craniofac Surg.2009. 20: 385–8.
Артикул Google Scholar
Туркула Л.Д., Вудс Дж. Э. Ограниченная или селективная узловая диссекция при злокачественной меланоме головы и шеи. Am J Surg. 1984. 148: 446–8.
CAS Статья Google Scholar
Ван де Ври В., Эггермонт А. М., Ван Путтен В. Л. и др. Лечебная лимфаденэктомия при меланомах головы и шеи. Голова Шея.1993; 15: 377–81.
Артикул Google Scholar
Йонк А., Строббе Л.Дж., Кроон Б.Б. и др. Метастазирование шейных лимфатических узлов при меланоме кожи головы и шеи: поиск факторов прогноза. Eur J Surg Oncol. 1998. 24: 298–302.
CAS Статья Google Scholar
Шен П., Ванек Л.А., Мортон Д.Л. Необходима ли адъювантная лучевая терапия после положительной лимфодиссекции при меланоме головы и шеи? Энн Сург Онкол.2000; 7: 554–9.
CAS Статья Google Scholar
Андерсен П.С., Чакера А.Х., Тамсборг А.К. и др. Рецидив и выживаемость после рассечения шеи при меланоме кожи головы и шеи. Дэн Мед Дж. 2014; 61 (12): A4953.
PubMed Google Scholar
Сонг Й., Тиенибер А.Д., Гимотти П.А., Митчелл Т.К., Амаравади Р.К., Шухтер Л.М., Фракер Д.Л., Каракусис Г.К.Результаты выживаемости пациентов с меланомой III клинической стадии в эпоху новых системных методов лечения. Энн Сург Онкол. 2019; 26 (13): 4621–30.
Артикул Google Scholar
Бервик М., Буллер Д. Б., Каст А., Галлахер Р., Ли Т. К., Мейскенс Ф., Пандей С., Томас Н. Э., Вейерод МБ, Уорд С. Эпидемиология и профилактика меланомы. Cancer Treat Res. 2016; 167: 17–49.
Артикул Google Scholar
Resteghini C, Trama A, Borgonovi E, Hosni H, Corrao G, Orlandi E, Calareso G, De Cecco L, Piazza C, Mainardi L, Licitra L. Большие данные по раку головы и шеи. Варианты лечения Curr Oncol. 2018; 19 (12): 62.
Артикул Google Scholar
Cohen N, Fedewa S, Chen AY. Эпидемиология и демография больных раком головы и шеи.

