Папилломавирусная инфекция и лейкоплакия шейки матки и влагалища
В последние годы большое внимание уделяется проблеме лейкоплакии различных локализаций. Однако следует отметить, что данная проблема в отношении гениталий остается нерешенной и представляет значительные трудности для практикующего врача. За рубежом, в тех странах, где профилактика рака шейки матки (РШМ) осуществляется в рамках организованного скрининга, данная патология чаще всего не включается в активный менеджмент и находится под наблюдением до тех пор, пока в цитологических мазках не выявляется патология LSIL (плоскоклеточное интраэпителиальное поражение низкой степени выраженности) или CIN I (цервикальная интраэпителиальная неоплазия слабовыраженная). Обычно это возникает тогда, когда происходит заражение вирусом папилломы человека (ВПЧ). Однако в нашей стране тактика обычно более активна.
Что же сегодня нового в данной проблеме и каков алгоритм действий врача?
Частота лейкоплакии в структуре заболеваний шейки матки (ШМ) составляет 5-8% [1, 2, 11, 12].
Лейкоплакия — это патологический процесс, который характеризуется нарушением основной функции МПЭ — функции гликогенобразования и процесса ороговения, который в норме отсутствует.
Происхождение и механизм развития лейкоплакии в точности не выяснены. Большинство исследователей рассматривают лейкоплакию как реакцию на различные экзогенные и эндогенные факторы. Некоторые авторы считают лейкоплакию синдромом, возникающим в результате длительного хронического воспаления в слизистой оболочке, вызванного различными инфекциями, повторными травмами, химическими и термическими раздражителями.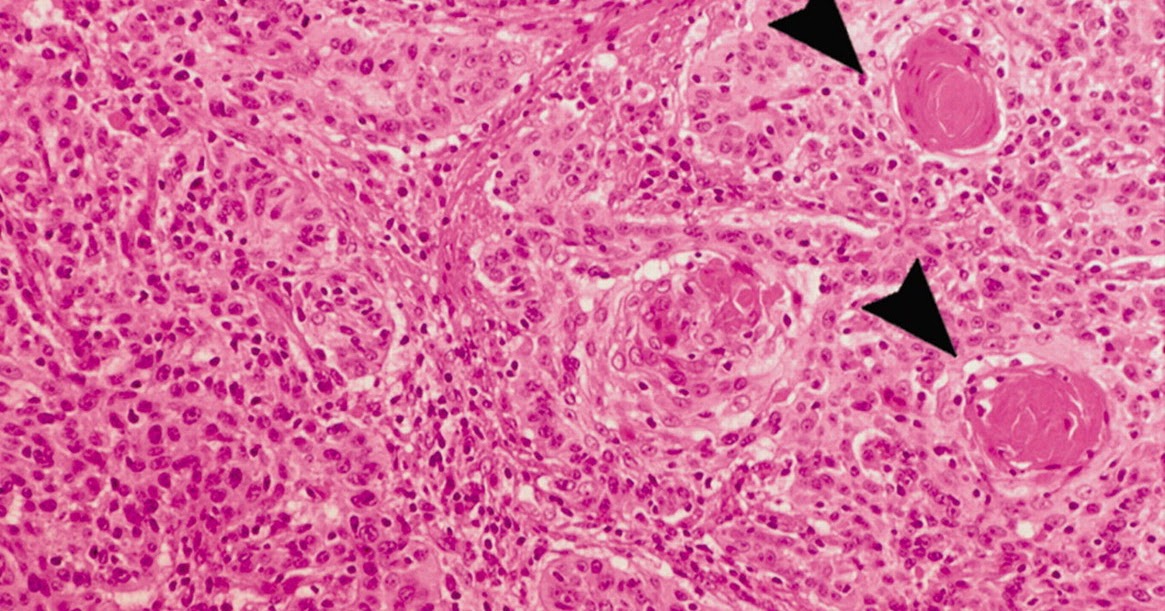
Также высказывается мнение, что в основе этого процесса лежат гормональные нарушения. Гиперкератоз наблюдают у женщин, принимающих высокие дозы эстрогенов системно или вагинально (например, в качестве предоперационной подготовки женщин в постменопаузе к гистерэктомии влагалищным доступом и ликвидации выпадения матки, для лечения тяжелых сенильных вагинитов). У женщин, длительно использующих вагинальные колпачки для контрацепции, вагинальный эпителий утолщен и непрозрачен. Полагают, что кислая реакция геля, используемого для смазки колпачка, стимулирует рост влагалищного эпителия. Лейкоплакия может возникать и при длительно существующем пролапсе матки и влагалища [8, 11].
Появляются исследования, изучающие роль папилломавирусной инфекции (ПВИ) в развитии лейкоплакии ШМ и вульвы. Однако научные данные сегодня свидетельствуют о том, что эти патологические состояния предпочтительно рассматривать как сопутствующие друг другу, но не причинно-следственные [8, 14, 17].
Роль ВПЧ
Как клинический диагноз, лейкоплакия в большинстве ситуаций не связана с инфицированием ВПЧ и не малигнизируется. Но может и сочетаться с ВПЧ, при этом данные зарубежной литературы по частоте сочетаемости двух диагнозов существенно отличаются от данных отечественных публикаций. Весьма вероятно, что инфицирование ВПЧ способствует малигнизации на фоне лейкоплакии, однако достаточных подтверждений этому факту нет.
Известно, что ПВИ гениталий характеризуется полиморфными многоочаговыми поражениями кожи и слизистых оболочек генитального тракта. Клинические проявления ПВИ определяются типом вируса и состоянием иммунной системы.
Кроме злокачественной патологии, которая является наиболее опасным следствием персистенции вируса папилломы онкогенных типов, известен целый ряд заболеваний, обусловленных ВПЧ. Экзофитные кондиломы (ЭК) в ранней фазе роста могут быть значительно кератинизированы и напоминать грубую лейкоплакию [1, 9].
Цитологический метод диагностики очень важен, но его результаты не всегда понятны. Так, мазки типа ASCUS (атипические клетки ПЭ неопределенного значения) и LSIL (low grade squamous intraepithelial lesion — плоскоклеточное внутриэпителиальное поражение низкой степени) у юных женщин встречаются чрезвычайно часто и рассматриваются как реактивные изменения эпителия в ответ на транзиторную ВПЧ-инфекцию. Поэтому тактика ведения предполагает повторное цитологическое исследование через 6-12 мес для уточнения диагноза. Имеются единичные работы, указывающие на ассоциацию гиперкератоза и SIL (squamous intraepitelial lesiones — плоскоклеточные интраэпителиальные поражения) [13, 17].
Так, мазки типа ASCUS (атипические клетки ПЭ неопределенного значения) и LSIL (low grade squamous intraepithelial lesion — плоскоклеточное внутриэпителиальное поражение низкой степени) у юных женщин встречаются чрезвычайно часто и рассматриваются как реактивные изменения эпителия в ответ на транзиторную ВПЧ-инфекцию. Поэтому тактика ведения предполагает повторное цитологическое исследование через 6-12 мес для уточнения диагноза. Имеются единичные работы, указывающие на ассоциацию гиперкератоза и SIL (squamous intraepitelial lesiones — плоскоклеточные интраэпителиальные поражения) [13, 17].
При сочетании лейкоплакии с наличием онкогенных типов ВПЧ и проявлениями LSIL, HSIL (плоскоклеточное интраэпителиальное поражение высокой степени выраженности) показаны физиохирургические методы лечения, которые, как известно, не обладают 100% эффективностью ввиду возможной персистенции ВПЧ на фоне нарушенного иммунитета.
Врачебная тактика интраэпителиальных поражений включает два основных метода лечения (аблация и эксцизия), каждый из которых имеет показания и противопоказания, но существует и возможность наблюдения без деструктивных вмешательств [8, 16].
Клиническая картина
Клинически лейкоплакия может протекать бессимптомно и представляет собой белое пятно с четкими границами на эпителии, видимое невооруженным глазом до любой обработки растворами. Оно может быть либо приподнято над поверхностью, либо быть на одном уровне с окружающим МПЭ.
Белый цвет лейкоплакии обусловлен ороговением и утолщением эпителиального пласта. В зависимости от интенсивности процесса ороговения, от плотности и толщины ороговевшего слоя различают нежную, тонкую, легко слущивающуюся лейкоплакию (К) и грубую, бородавчатую, в виде плотных бляшек, плотно спаянную с подлежащей тканью. Лейкоплакия К, как правило, располагается на участках зоны трансформации (ЗТ), но нередко может обнаруживаться среди здорового эпителия вне ЗТ.
Размеры лейкоплакии могут быть различными — от точечного до обширных бляшек, занимающих всю поверхность ШМ и даже влагалища. В тех участках, где лейкоплакия К легко слущивается при влагалищном исследовании, при протирании тампоном, при спринцевании, она легко и быстро возникает вновь.
Кольпоскопическая картина
Лейкоплакия имеет вид белесоватых бляшек, гладких или слегка приподнятых над окружающей тканью, с отчетливо очерченными границами. Контуры их часто бывают причудливыми. В зависимости от толщины лейкоплакия К выглядит как простое белое пятно или как возвышенная бугристая поверхность. Иногда кератотические наложения разбросаны по поверхности в виде глыбок. Проба Шиллера всегда отрицательная.
Нередко такие признаки, как мозаика, пунктация и кератоз появляются одновременно. Эта ситуация также вызывает обеспокоенность. Иногда кератоз представляет собой ороговевшие наложения, напоминающие творожистые бели при кандидозе, и может быть удален тампоном; тогда под слоем ороговения четко определяется пунктация или мозаика.
ВПЧ-инфекция, кератинизированная CIN, РШМ, хроническая травма, врожденная ЗТ (ВЗТ) и другие состояния могут кольпоскопически проявиться в виде лейкоплакии.
Наибольшие разночтения представляет собой так называемая врожденная зона трансформации. Гистологически ВЗТ представляет собой зону, где эндоцервикальный эпителий подвергся метаплазии еще во внутриутробном периоде жизни и раннем периоде новорожденности, когда под влиянием материнских эстрогенов поддерживались процессы метаплазии. Возможно, определенную роль в формировании ВЗТ играет прием матерью гормональных средств, в частности, диэтилстильбэстрола. Граница или стык ВЗТ с нормальным МПЭ четкая, часто распространяется с экзоцервикса на своды влагалища. Отсутствие гликогена делает этот участок йоднегативным. В практике его принимают за лейкоплакию или CIN и нередко подвергают неоднократным аблациям, которые, надо отметить, бывают малоэффективными. Биопсия при ВЗТ обязательна. Гистологическое заключение в большинстве случаев — «паракератоз, акантоз».
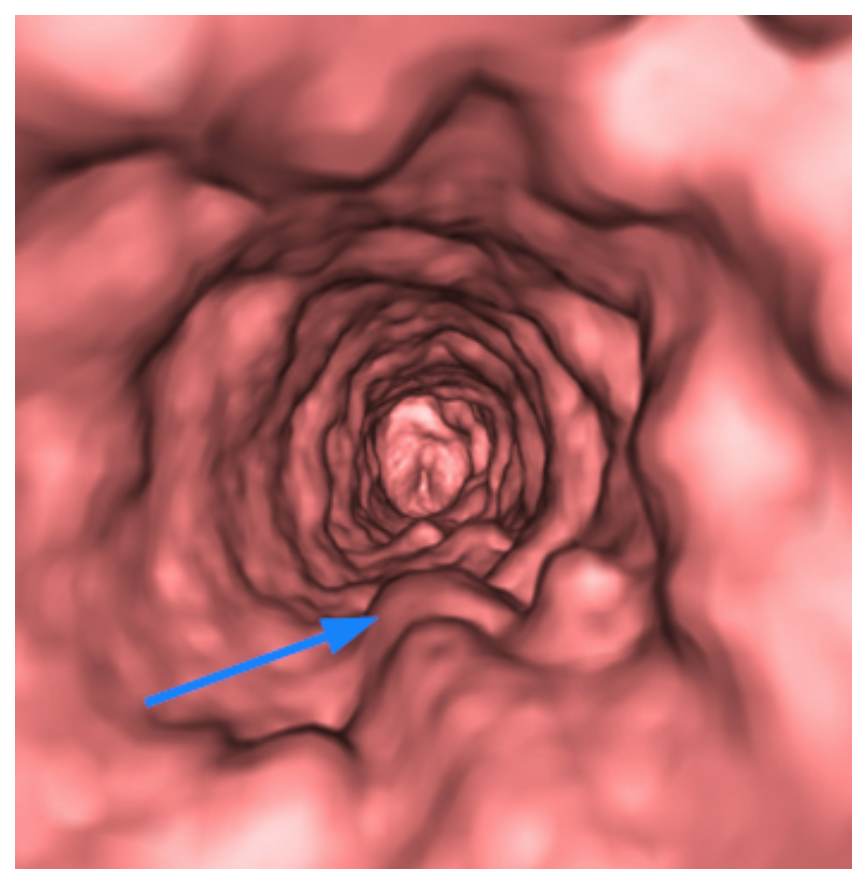
При ВЗТ (клинически обширная лейкоплакия) у части пациенток при кольпоскопии (КС) признаков аномального образования нет, только при пробе Шиллера появляется нерезкий йоднегатив, иногда распространяющийся на своды влагалища (см. рисунок на цв. вклейке).Рисунок 1. Кольпоскопическая картина обширной лейкоплакии при наличии врожденной зоны трансформации. Фото. У другой части женщин этот участок может быть слегка ацетобелым. У части пациенток на фоне обширного йоднегативного участка, переходящего на своды, имеются очаговые наложения белого цвета, которые занимают различную площадь от точечных кератотических вкраплений до обширных пластинчатых кератотических наложений различной толщины. Иногда ВЗТ содержит нежную мозаику или тонко калиброванные сосуды по всей поверхности.
Существует еще ряд других смешанных кольпоскопических картин, когда лейкоплакия сочетается с той или иной патологией ШМ.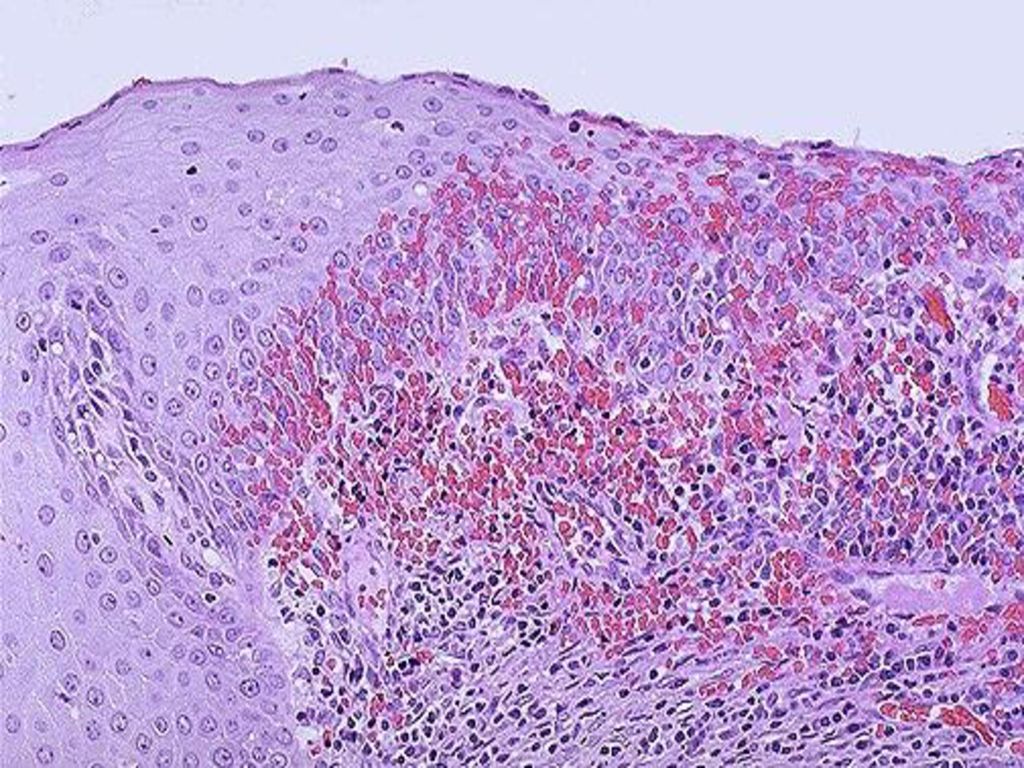
Морфологическая картина
При цитологическом методе диагностики лейкоплакии выявляются скопления поверхностных клеток, лишенных ядер, цитоплазма которых хорошо окрашивается в желтый или оранжевый цвет. Цитологическое исследование позволяет выявить атипию клеток, но в материал часто не попадают атипические клетки с дискариозом ввиду того, что мазок берется с поверхностного слоя эпителия, где имеет место выраженный гиперкератоз. В связи с этим проведение прицельной биопсии при лейкоплакии в нашей стране является обязательным [9, 14, 17].
При повторяющемся повреждении усиленная пролиферация клеток парабазального слоя может привести к утолщению МПЭ в любом локусе организма, в том числе ШМ и влагалища. Процесс характеризуется удлинением межсосочковых отростков (акантоз) и ороговением клеток поверхностного слоя (гиперкератоз). Паракератоз является результатом усиленной дифференцировки МПЭ.
Паракератоз не имеет клинического значения, являясь реакцией эпителия на хроническое повреждение, но может быть косвенным признаком вирусного поражения и скрывать расположенные под ним дисплазию и рак.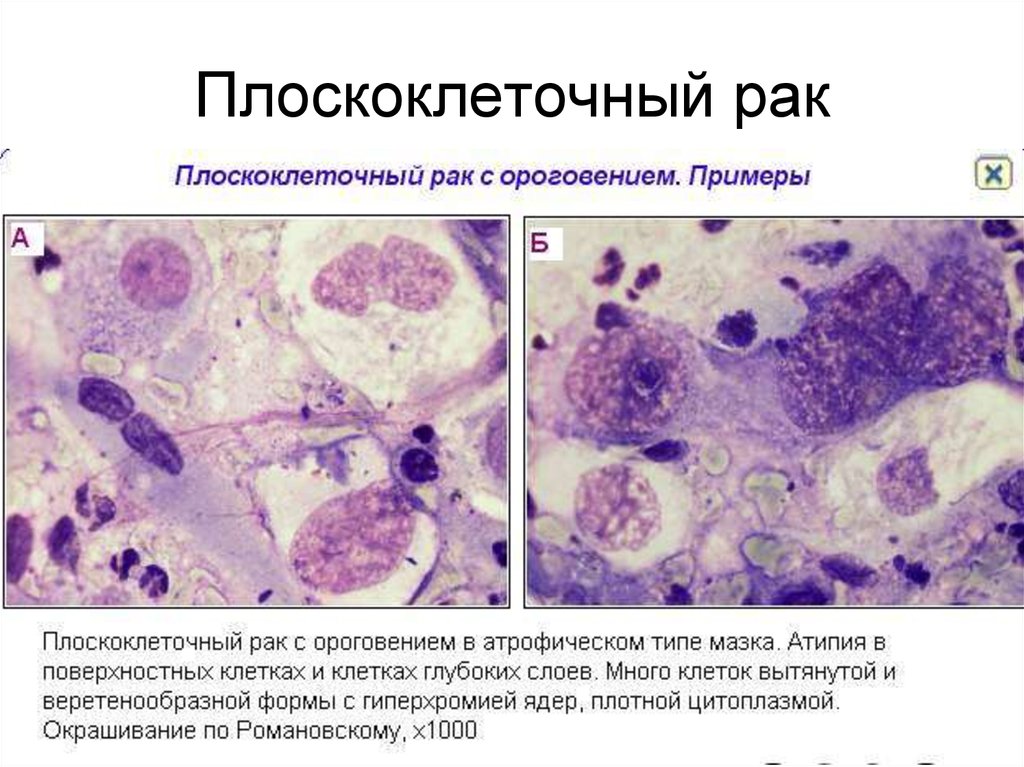 Гиперкератоз — это патологическое ороговение (избыточное накопление в цитоплазме белков цитокератинов) с разрушением ядер поверхностных клеток многослойного плоского неороговевающего эпителия и преобразованием их в безъядерные чешуйки, иногда обширные, из блестящих безъядерных клеток [14, 17].
Гиперкератоз — это патологическое ороговение (избыточное накопление в цитоплазме белков цитокератинов) с разрушением ядер поверхностных клеток многослойного плоского неороговевающего эпителия и преобразованием их в безъядерные чешуйки, иногда обширные, из блестящих безъядерных клеток [14, 17].
Сложность диагностики лейкоплакии связана с тем, что на разных участках ШМ этот процесс может иметь различное гистологическое строение, в том числе и CIN, если присутствует ВПЧ-инфекция.
Иммуномодулирующее лечение при лейкоплакии, осложненной наличием ВПЧ-инфекции
Вопросы иммунотерапии продолжают быть дискуссионными и включают возможности индивидуального подхода в каждом случае. Данные клинических испытаний различных иммуномодулирующих средств противоречивы [1, 2, 4, 12, 15, 16]. К сожалению, специфических лекарственных средств, полностью элиминирующих ВПЧ, на сегодняшний день не создано. Однако при изучении состояния иммунной системы у женщин, страдающих ПВИ и другими урогенитальными инфекциями, были выявлены нарушения различных ее звеньев на локальном и системном уровнях. В связи с этим продолжается поиск эффективных иммунопрепаратов при ВПЧ, при этом предпочтение отдается топическим препаратам, так как ВПЧ является строго эпителиотропным возбудителем, и воздействие непосредственно на эпителий является необходимым условием [9, 15].
В связи с этим продолжается поиск эффективных иммунопрепаратов при ВПЧ, при этом предпочтение отдается топическим препаратам, так как ВПЧ является строго эпителиотропным возбудителем, и воздействие непосредственно на эпителий является необходимым условием [9, 15].
Одно из серьезных отечественных плацебо-контролируемых исследований посвящено оценке эффективности локального препарата интерферона (ИФН) у ВПЧ-позитивных женщин репродуктивного возраста, у которых результаты цитологического исследования свидетельствовали о наличии LSIL, где показано, что локальный вагинальный препарат эффективен в лечении LSIL, ассоциированных с ВПЧ высокоонкогенного риска и способствует их регрессу [9]. Сопоставимый результат отмечают другие авторы при внутрикондиломном введении ИФН-β в ЭК [16]. За рубежом имеется большой опыт применения имиквимода — индуктора цитокинов кожи, который используется в виде крема для лечения кондилом [15]. В целом анализ результатов клинических исследований, посвященных лечению субклинических форм ПВИ, не является однозначным [16].
На российском аптечном рынке представлено множество противовирусных препаратов, обладающих функцией активации иммунитета. Одним из наиболее клинически апробированных является отечественный препарат панавир, который обладает оригинальными фармакологическими свойствами, является противовирусным и иммуномодулирующим средством. Он повышает неспецифическую резистентность организма к инфекциям, способствует индукции ИФН.
Панавир — препарат растительного происхождения. На молекулярном уровне он взаимодействует с поверхностью мембран клеток-мишеней и конкурирует с вирусом за рецепторы, благодаря которым происходит присоединение и проникновение вируса в клетку, а также стимулирует выработку окиси азота, которая оказывает инактивирующее действие на вирусные частицы [4].
Многочисленные наблюдения показали, что в терапевтических дозах препарат хорошо переносится. Испытания не обнаружили у него мутагенного, тератогенного, канцерогенного, аллергизирующего и эмбриотоксического действия. Панавир одновременно проявляет и прямое противовирусное действие (блокируя синтез вирусных белков), и иммуномодулирующее (стимулируя синтез ИФН), что позволяет использовать его в монотерапии вирусных инфекций, не прибегая к комбинации противовирусного препарата и иммуномодулятора. Препарат рекомендован для комплексной терапии герпесвирусных инфекций различной локализации, ПВИ, цитомегаловирусной инфекции у пациенток с привычным невынашиванием беременности, вторичных иммунодефицитных состояний на фоне инфекционных заболеваний [5-7].
Панавир одновременно проявляет и прямое противовирусное действие (блокируя синтез вирусных белков), и иммуномодулирующее (стимулируя синтез ИФН), что позволяет использовать его в монотерапии вирусных инфекций, не прибегая к комбинации противовирусного препарата и иммуномодулятора. Препарат рекомендован для комплексной терапии герпесвирусных инфекций различной локализации, ПВИ, цитомегаловирусной инфекции у пациенток с привычным невынашиванием беременности, вторичных иммунодефицитных состояний на фоне инфекционных заболеваний [5-7].
Применительно к рассматриваемой проблеме наиболее удобны вагинальные формы препарата, а именно вагинальные суппозитории, которые недавно появились в практике. При интравагинальной локализации процесса чаще всего рекомендуется курс вагинальных свечей: по одной на ночь в течение 5-10 дней. В зависимости от степени выраженности вирусного заболевания курс применения вагинальных свечей согласно инструкции может варьировать от 2 до 5 с интервалом в 24 ч. Следует помнить, что свечи должны храниться в сухом, защищенном от света месте, при температуре окружающей среды от +2 до +10 °C.
Следует помнить, что свечи должны храниться в сухом, защищенном от света месте, при температуре окружающей среды от +2 до +10 °C.
За период 2012-2013 гг. мы наблюдали 72 женщин с гистологически подтвержденными различными формами лейкоплакии, из них у 36 (50%) выявлена ВПЧ-инфекция (различные типы вируса). Это наблюдение не может служить подтверждением какой-либо роли ВПЧ в генезе лейкоплакии, однако известно, что инфицирование ВПЧ повышает вероятность малигнизации, в связи с чем мы посчитали целесообразным проведение пробного курса иммунотерапии для повышения вероятности элиминации ВПЧ и снижения риска малигнизации.
Мы имеем опыт применения вагинальных свечей панавир у 36 женщин в возрасте от 18 до 49 лет с лейкоплакией ШМ и влагалища при ее сочетании с инфицированием ВПЧ. У 12 женщин имелась лейкоплакия в виде обширной зоны трансформации с переходом на своды влагалища (1-я подгруппа), при этом у 4 из них при гистологическом исследовании отмечены признаки LSIL, у 8 женщин (2-я подгруппа) лейкоплакия ШМ сочеталась с наличием ЭК, у 16 — лейкоплакия различных размеров локализовалась на ШМ (3-я подгруппа), при этом у 4 из них имелись гистологические признаки LSIL.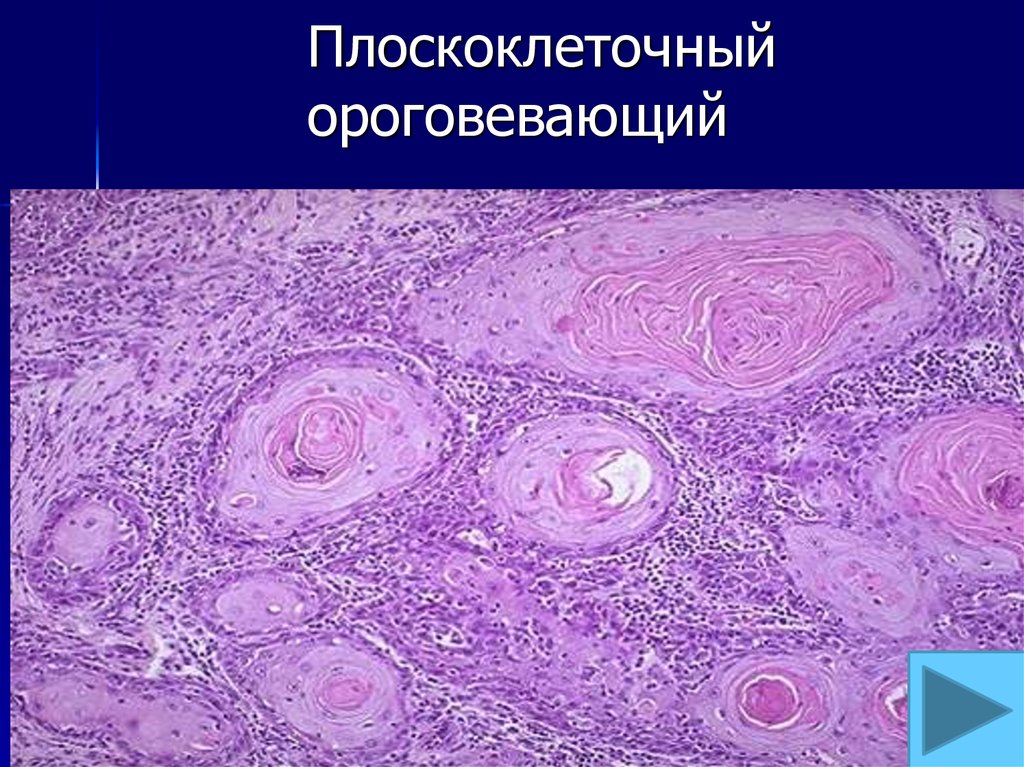 Таким образом, у 16 из 36 (43%) женщин лейкоплакия сочеталась с ВПЧ-ассоциированным заболеванием, у 20 из них ВПЧ-инфекция имела латентную форму.
Таким образом, у 16 из 36 (43%) женщин лейкоплакия сочеталась с ВПЧ-ассоциированным заболеванием, у 20 из них ВПЧ-инфекция имела латентную форму.
ЭК локализовались в области влагалища — у 6 из 8 женщин, на ШМ — у 2 пациенток. Обширная лейкоплакия с переходом на своды влагалища проявлялась кольпоскопически в виде йоднегативной зоны у 9 из 12 женщин, сопровождалась кератотическими наложениями белого цвета у 3 из 12. У остальных женщин кольпоскопически определялась лейкоплакия в виде белых пятен с кератотическим налетом в большинстве случаев.
Все пациентки подверглись деструктивному лечению с применением радиоволнового метода или аргоноплазменного облучения (аппарат Фотек-141). Всем женщинам до аблации рекомендовали панавир — вагинальные суппозитории курсом 10, ежедневно на ночь.
Методы обследования пациенток: КС, ВПЧ-тест с помощью полимеразной цепной реакции (ПЦР) с генотипированием, цитологическое исследование, биопсия точечная в случаях адекватной КС или эксцизионная в случаях неадекватной КС, когда атипически измененный эпителий пролонгировался в цервикальный канал (ЦК), диагностическое выскабливание эпителия ЦК в 3 случаях, УЗИ для выявления объемных образований ШМ неясной этиологии, бактериоскопический и бактериологический методы с ПЦР при наличии воспалительного процесса, гормональное обследование при подозрении на соответствующие нарушения. Наблюдение за пациентками осуществлялось через 3 и 6 мес после аблативных процедур на ШМ с контролем методами ПЦР, ВПЧ-теста, цитологического исследования, КС. По показаниям женщин осматривали в другие сроки.
Наблюдение за пациентками осуществлялось через 3 и 6 мес после аблативных процедур на ШМ с контролем методами ПЦР, ВПЧ-теста, цитологического исследования, КС. По показаниям женщин осматривали в другие сроки.
Процедура аблации была выполнена у женщин 1-й подгруппы с обширной лейкоплакией (ВЗТ) частично с захватом области экзоцервикса, наружного зева и одного из сводов влагалища. Через 1,5 мес принималось решение о целесообразности дальнейшей деструктивной терапии. У 5 женщин эпителизация отмечена в полном объеме с полноценным ПЭ, позитивным на пробу с раствором Люголя. Поэтому этим 5 женщинам была выполнена повторная аблация и достигнуто полное излечение. У 2 женщин эффект был частичный, у 5 — эпителизация после аблации происходила за счет ПЭ, йоднегативного при пробе с раствором Люголя. Таким образом, у 7 из 12 женщин полного клинического эффекта не было отмечено и пациенткам было рекомендовано воздерживаться от дальнейшей деструктивной терапии ввиду отсутствия полноценной эпителизации.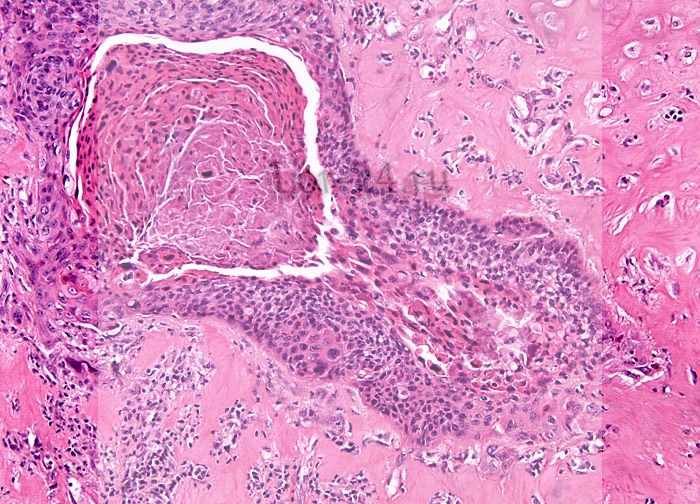 Полагают, что при ВЗТ у части женщин потенциал резервных (стволовых) клеток эпителия снижен, и поэтому полноценной эпителизации добиться не удается. Этот вопрос нуждается в изучении с применением современных высокотехнологичных методов обследования.
Полагают, что при ВЗТ у части женщин потенциал резервных (стволовых) клеток эпителия снижен, и поэтому полноценной эпителизации добиться не удается. Этот вопрос нуждается в изучении с применением современных высокотехнологичных методов обследования.
Во 2-й и 3-й подгруппах (24 пациентки) после аблации была отмечена полноценная эпителизация к 3-му месяцу у 20 (83%) женщин, у 4 (17%) — эффект был частичным.
Цитологическое исследование через 3 и 6 мес не выявило признаков SIL ни в одном случае во всех группах. Позитивный ВПЧ-тест отмечен только у 6 (16,9%) из 36 наблюдаемых женщин через 6 мес наблюдения. При лечении панавиром побочные эффекты (быстро проходящее покраснение и зуд в области вагины и половых губ) отмечены у 2 пациенток. Других побочных эффектов выявлено не было. Указанные результаты свидетельствуют об относительной безопасности вагинальных форм панавира.
Рецидив лейкоплакии после комплексного лечения отмечен у одной пациентки 3-й подгруппы, и рецидив ЭК наблюдался в одном случае в течение 6 мес, стойкое клиническое излечение с элиминацией ВПЧ на фоне применения панавира отмечено у 80% женщин.
Нам пока не удалось набрать контрольную группу для лечения лейкоплакии, сочетающейся с ВПЧ-инфекцией, ввиду довольно редкой и сложной патологии, особенно когда обсуждается вопрос о наличии ВЗТ, однако клинический эффект в 80% случаев при ВПЧ-инфекции/лейкоплакии, значительно превышающий таковой по данным литературы, можно считать достаточно высоким. Наш опыт указывает на позитивное влияние вагинальных суппозиториев панавир как противовирусного препарата. Мы полагаем, что его воздействие на пораженный ВПЧ эпителий при лейкоплакии приводит к снижению активности вируса, что позволяет повысить полноценность эпителизации после аблации лейкоплакии.
Таким образом, проблема диагностики лейкоплакии и тактики ее клинического ведения продолжает оставаться чрезвычайно актуальной. Данные доказательной медицины на сегодняшний день обусловили более щадящую тактику в отношении лейкоплакии как самостоятельного заболевания, имеющего низкий риск малигнизации при отсутствии инфицирования ВПЧ. Однако ввиду высокой распространенности ВПЧ-инфекции в настоящее время при наличии кольпоскопических признаков лейкоплакии показано дополнительное обследование. При наличии морфологических признаков ВПЧ или дисплазии эта патология уже расценивается как CIN, несмотря на кольпоскопические и дополнительные неспецифические признаки кератоза.
Однако ввиду высокой распространенности ВПЧ-инфекции в настоящее время при наличии кольпоскопических признаков лейкоплакии показано дополнительное обследование. При наличии морфологических признаков ВПЧ или дисплазии эта патология уже расценивается как CIN, несмотря на кольпоскопические и дополнительные неспецифические признаки кератоза.
удаление и лечение вируса папилломы
Существует множество типов вируса папилломы человека, в настоящее время известны более 65 из них. В зависимости от типа ВПЧ, вирус проявляется разными типами кожных новообразований:
- типы ВПЧ 1, 2, 3, 4, 5, 7-10, 12, 14, 15, 17, 19-24 вызывают поражения кожи – бородавки различных видов;
- типы вируса папилломы человека 6, 11, 13 16, 18, 31, 33, 35 «ответственны» за новообразования, поражающие слизистые – остроконечные кондиломы и папилломы.
Вирус папилломы человека живет в крови; он не проявляет себя, если иммунная система вирусоносителя работает хорошо, но начинает прогрессировать, если иммунитет человека ослаблен, тогда необходимо приступат к лечению вируса папилломы. ВПЧ может жить в организме носителя в течение многих лет, иногда с самого рождения, а впервые проявиться во взрослом возрасте из-за снижения иммунитета. Вирус способствует изменению функций эпителиальных клеток кожи, которые и приводят к появлению новообразований на коже или слизистых, в зависимости от типа ВПЧ.
ВПЧ может жить в организме носителя в течение многих лет, иногда с самого рождения, а впервые проявиться во взрослом возрасте из-за снижения иммунитета. Вирус способствует изменению функций эпителиальных клеток кожи, которые и приводят к появлению новообразований на коже или слизистых, в зависимости от типа ВПЧ.
Кроме того, одни типы вируса папилломы человека относятся к вирусам высокого онкогенного риска (то есть способны провоцировать развитие онкологических заболеваний), а другие типы ВПЧ не вызывают злокачественных образований. К первой группе типов вируса папилломы человека относятся, прежде всего, типы ВПЧ 16, 18, 31 и 45, которые увеличивают риск предраковых заболеваний и рака половых органов , но не вызывают остроконечные кондиломы, эти типы вирусов требуют лечения папилломы . Они могут вызывать плоскоклеточный рак промежности, вульвы, шейки матки, полового члена , заднепроходного канала. Особенно опасны эти типы папилом для женщин – по данным исследований, вирус папилломы человека, переданный половым путем, в 60 раз увеличивает для женщины риск заболеть раком шейки матки, особенно при наличии эрозии шейки матки. С другой стороны, рак шейки матки развивается менее чем у 1% женщин, зараженных ВПЧ – обычно инфекция протекает бессимптомно.
С другой стороны, рак шейки матки развивается менее чем у 1% женщин, зараженных ВПЧ – обычно инфекция протекает бессимптомно.
Типы вируса папилломы низкого онкогенного риска могут вызывать остроконечные кондиломы, но не связаны с предраковыми заболеваниями и раком половых органов. К этой группе относятся, главным образом, 6 и 11 типы ВПЧ. Главное, что нужно запомнить: риск появления злокачественных новообразований вызывают остроконечные кондиломы на шейке матки у женщин или на головке полового члена у мужчин. Кондиломы, локализованные в остальных местах (в том числе и в области половых органов) не представляют онкогенной опасности и вызывают по большей части косметические неудобства.
Носитель может сам не знать о присутствии ВПЧ в организме, что усложняет подход к лечению вируса папилломы. Вирус папилломы человека очень распространен, можно сказать даже, что присутствие этого вируса в человеческом организме встречается чаще, чем его отсутствие и не всегда требуется лечение папилломы. Носителями вируса папилломы человека является большинство людей, которые в свою очередь заражают ВПЧ других. По данным исследований, остроконечные кондиломы, то есть внешние проявления папилломовирусной инфекции (ПВИ) встречаются у трети женщин репродуктивного возраста, проходящих плановое обследование. На возрастную группу 15-25-летних сексуально активных женщин приходится и максимальная частота распространения вируса папилломы человека, для этой группы необходимо обязательное обследование и своевременное папилломы лечение.
Носителями вируса папилломы человека является большинство людей, которые в свою очередь заражают ВПЧ других. По данным исследований, остроконечные кондиломы, то есть внешние проявления папилломовирусной инфекции (ПВИ) встречаются у трети женщин репродуктивного возраста, проходящих плановое обследование. На возрастную группу 15-25-летних сексуально активных женщин приходится и максимальная частота распространения вируса папилломы человека, для этой группы необходимо обязательное обследование и своевременное папилломы лечение.
В медицинской литературе выделяется определенная группа риска ПВИ. В частности, в нее входят люди, рано начавшие активную половую жизнь. Наиболее часто заболевание встречается у женщин, имеющих половые связи со многими партнерами, и у женщин, чьи мужья имеют многочисленные внебрачные связи.
У 65-70% заболевших ПВИ остроконечные кондиломы выявляют у обоих половых партнёров, поэтому партнеры заболевших людей также относятся к группе риска, для них лечение вируса папилломы назначают одновременно.
Косвенными факторами риска можно назвать курение, употребление алкоголя и наркотиков. К факторам риска относятся и все заболевания, которые ослабляют иммунитет человека, прежде всего ВИЧ-инфекция. Развитие папиллом могут спровоцировать стрессы, вирусные заболевания (включая герпес), грипп, долгое лечение сильнодействующими лекарствами, подавляющими иммунитет, при этом лечение папилломы назначают параллельно с лечением сопутствующего заболевания.
В отличие от многих других инфекций , при диагностике вируса папилломы человека (ВПЧ) часто бывает достаточно осмотра пациента. Это утверждение верно только к тем случаям, когда проявления папилломовирусной инфекции имеют вид типичных остроконечных кондилом , которые специалист не может спутать ни с какими другими новообразованиями, при этом назначается лечение вируса папилломы. Диагностирование ВПЧ по клиническим проявлениям является основным типом диагностики, так как при отсутствии кондилом лечение папиллом не назначают.
Однако чтобы выявить, какой тип вызвал разрастания придется сдать анализы: существуют вирусы папилломы высокого онкогенного риска.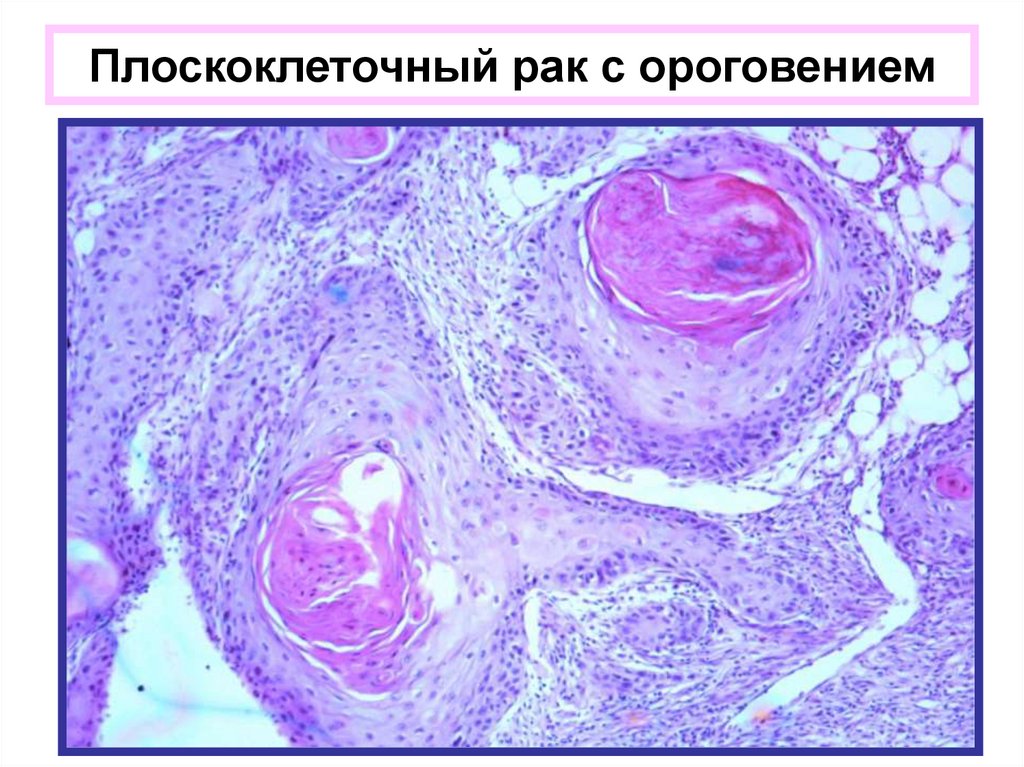 Для выявления ВПЧ и определения его типа обычно используют метод ПЦР – классическую ДНК — диагностику вируса папилломы. Это исследование должны проходить и те пациенты, у которых при осмотре были диагностированы папилломы, так как важно определить не только наличие вируса папилломы человека в организме, но и его тип , а также количество вируса на момент проведения анализа.
Для выявления ВПЧ и определения его типа обычно используют метод ПЦР – классическую ДНК — диагностику вируса папилломы. Это исследование должны проходить и те пациенты, у которых при осмотре были диагностированы папилломы, так как важно определить не только наличие вируса папилломы человека в организме, но и его тип , а также количество вируса на момент проведения анализа.
Определение количества ВПЧ помогает определить, было ли появление кондилом следствием одномоментного снижения иммунитета или же это хронический процесс, который тянется многие годы. Кроме того, ПЦР-диагностика помогает выяснить, какой именно вид вируса папилломы человека присутствует организме пациента. Это необходимо для того, чтобы определить риск онкогенности ВПЧ в каждом конкретном случае.
Кроме самого пациента с остроконечными кондиломами, анализ методом ПЦР хорошо бы сделать всем его половым партнерам. Положительный результат анализа при отсутствии проявлений заболевания означает необходимость провести профилактику развития вируса в организме. Вылечить вирус папилломы окончательно невозможно, однако возможности современной медицины позволяют «усыпить» вирус и его активность на несколько лет! Кроме ПЦР-метода используются и другие методы диагностики ПВЧ, в частности кольпоскопическое исследование и биопсия.
Вылечить вирус папилломы окончательно невозможно, однако возможности современной медицины позволяют «усыпить» вирус и его активность на несколько лет! Кроме ПЦР-метода используются и другие методы диагностики ПВЧ, в частности кольпоскопическое исследование и биопсия.
Плоскоклеточная папиллома шейки матки (идентификатор концепции: C1336900) — MedGen
Папиллома, возникающая из плоского эпителия шейки матки. [из NCI]
Этиология
Рак шейки матки в Ливане: заболеваемость, временные тенденции и сравнение со странами из разных регионов мира.
Лаккис Н.А.,
Осман МХ,
Abdallah RM
Контроль рака
2022 янв-декабрь;29:10732748211068634.
дои: 10.1177/10732748211068634.
PMID: 35012377Free PMC Статья
Аденокарциномы шейки матки, не связанные с вирусом папилломы человека. Цитологические особенности и диагностическое согласие с использованием цифровой цитологической визуализации всего предметного стекла.
Негри Г,
Мачоку Э,
Цепурнайте Р,
Касал А,
Тронконе Г,
Стейнкассер М,
Vittadello F
Диагност Цитопатола
2021 фев; 49 (2): 316-321. Epub 2020 Окт 29
doi: 10.1002/dc.24652.
PMID: 33118707
Epub 2020 Окт 29
doi: 10.1002/dc.24652.
PMID: 33118707
Проточная цитометрия Характеристика плюрипотентных трансмембранных гликопротеинов на резидентных клетках шейки матки у пациентов, прошедших скрининг на рак шейки матки.
Колакурчи Н.,
Скеттино МТ,
Гримальди В,
Де Лука Ф.П.,
Мансуэто Г,
Коста Д,
Каччаторе Ф,
Де Францискис П.,
Napoli C
Рак Инвест
2020 апр;38(4):228-239.
Epub 2020 13 апр.
дои: 10.1080/07357907.2020.1742349.
PMID: 32208057
p16 Положительная гистологически мягкая плоскоклеточная метаплазия шейки матки: что это означает?
Гоял А,
Элленсон Л.Х.,
Pirog EC
Am J Surg Pathol
2020 Январь; 44 (1): 129-139.
doi: 10.1097/PAS.0000000000001364.
PMID: 31498174
Цитокины слизистой оболочки шейки матки и папилломавирусная инфекция шейки матки: описательное исследование.
Даниилидис А,
Куцос Дж,
Ойконому З.,
Насютцики М,
Хаципарадизи К.,
Тантанасис Т
Акта Цитол
2016;60(1):58-64.
Epub 2016 23 марта
дои: 10.1159/000445161.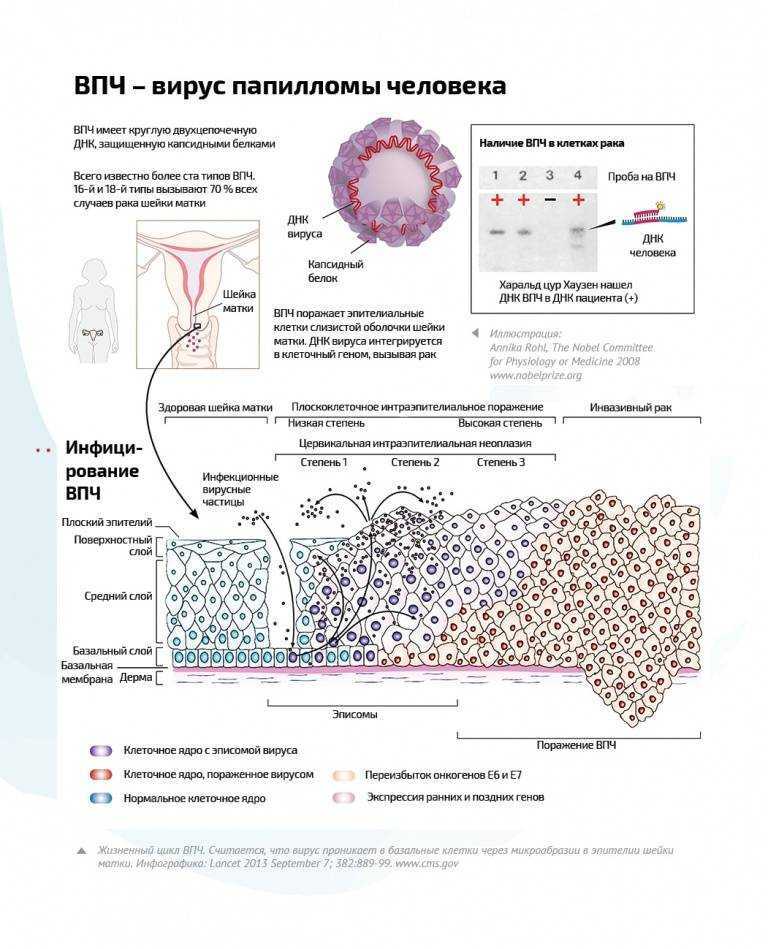 PMID: 27003414
PMID: 27003414
Просмотреть все (476)
Диагноз
Взаимосвязь между метаболическими данными 18F-FDG ПЭТ/КТ до лечения и ответом на лечение у пациентов с раком шейки матки.
Йылмаз БД,
Karyagar SS
Hell J Nucl Med
2021 янв-ап;24(1):18-24.
Epub 2021 20 апр
дои: 10.1967/s002449912302.
PMID: 33866335
Не связанные с вирусом папилломы человека аденокарциномы шейки матки. Цитологические особенности и диагностическое согласие с использованием цифровой цитологической визуализации всего предметного стекла.
Негри Г,
Мачоку Э,
Цепурнайте Р,
Касал А,
Тронконе Г,
Стейнкассер М,
Vittadello F
Диагност Цитопатола
2021 фев; 49 (2): 316-321.
Epub 2020 Окт 29
doi: 10.1002/dc.24652.
PMID: 33118707
p16 Положительная гистологически мягкая плоскоклеточная метаплазия шейки матки: что это означает?
Гоял А,
Элленсон Л.Х.,
Pirog EC
Am J Surg Pathol
2020 Январь; 44 (1): 129-139.
doi: 10.1097/PAS.0000000000001364.
PMID: 31498174
Себорейные кератозоподобные поражения шейки матки и влагалища: сообщение о новой сущности, возможно связанной с инфекцией вирусом папилломы человека с низким риском.
Талия КЛ,
McCluggage WG
Am J Surg Pathol
2017 Апрель; 41 (4): 517-524.
doi: 10.1097/PAS.0000000000000762.
PMID: 27792064
Гигантские кондиломы шейки матки: необычная форма, связанная с инфекцией вирусом папилломы человека низкого риска.
Парра-Эрран С,
Херфс М,
Дориа М,
Крам КП,
Nucci MR
Am J Surg Pathol
2013 фев; 37 (2): 300-4.
doi: 10.1097/PAS.0b013e31826d261e.
PMID: 23282973
Просмотреть все (376)
Терапия
Алгоритмы тестирования для диагностики злокачественных железистых опухолей шейки матки, гистотипированных в соответствии с Международной системой критериев и классификации эндоцервикальной аденокарциномы (IECC).
Дагган Массачусетс,
Дуан Кью,
Пфайффер Р.М.,
Бретт М.А.,
Ли С,
Абубакар М,
Кёбель М,
Родригес М,
Sar A
Appl Immunohistochem Mol Morphol
2022 1 февраля; 30 (2): 91-98.
doi: 10.1097/PAI.0000000000000988.
PMID: 34799503Free PMC Article
Местное иссечение с сохранением фертильности под гистероскопом с комбинированной химиотерапией у 6-летнего ребенка со светлоклеточной аденокарциномой шейки матки: клинический случай и обзор литературы.
Су Ю,
Чжан С,
Хоу В,
Лю Ю,
Чен Ю,
Се Ю,
Чжан Д,
Джи П,
Чен Р,
Цзян Г,
Чжан М
Медицина (Балтимор)
2020 янв;99(5):e18646.
doi: 10.1097/MD.0000000000018646.
PMID: 32000369Free PMC Article
Инфекция, вызванная вирусом папилломы человека, у ВИЧ-инфицированных женщин в Бельгии: значение для профилактических вакцин среди этой подгруппы населения.
Менон С,
Росси Р,
Беной я,
Богерс Дж. П.,
van den Broeck D
Eur J Рак Предыдущая
2018 янв; 27(1):46-53.
doi: 10.1097/CEJ.0000000000000271.
PMID: 27359375
Роль полимеразной цепной реакции вируса папилломы человека высокого риска в скрининге высокодифференцированных плоскоклеточных интраэпителиальных поражений слизистой оболочки анального канала у мужчин, инфицированных вирусом иммунодефицита человека, имеющих половые контакты с мужчинами.
Идальго-Тенорио С,
Риверо-Родригес М.,
Гил-Ангита С,
Эскивиас Дж,
Лопес-Кастро Р.,
Рамирес-Табоада Дж.,
де Йерро М.Л.,
Лопес-Руис М.А.,
Мартинес Р.Дж.,
Llano JP
PLoS One
2015;10(4):e0123590. Epub 2015 7 апр.
doi: 10.1371/journal.pone.0123590.
PMID: 25849412Free PMC Статья
Epub 2015 7 апр.
doi: 10.1371/journal.pone.0123590.
PMID: 25849412Free PMC Статья
Оценка элиминации вируса папилломы человека из шейки матки с помощью инфракрасного лазерного воздействия.
Дымковец В.П.,
Ежов В.В.,
Маныкин АА,
Белов С.В.,
Данилейко Ю.К.,
Осико В.В.,
Салюк В.А.
Bull Exp Biol Med
2011 декабрь; 152(2):228-30.
doi: 10.1007/s10517-011-1495-5.
PMID: 22808467
Просмотреть все (118)
Прогноз
Рак шейки матки в Ливане: заболеваемость, временные тенденции и сравнение со странами из разных регионов мира.
Лаккис Н.А.,
Осман МХ,
Abdallah RM
Контроль рака
2022 янв-декабрь;29:10732748211068634.
дои: 10.1177/10732748211068634.
PMID: 35012377Free PMC Артикул
Вирус папилломы человека Инфекция шейки матки и спектр патологии шейки матки при вирусе иммунодефицита человека/СПИД.
Джайн ББ,
Адхикари Т,
Садхухан ПК,
Nandi A
J Рак Res Ther
2021, октябрь-декабрь; 17 (6): 1462-1467.
doi: 10.4103/jcrt.JCRT_552_19. PMID: 34916378
PMID: 34916378
Взаимосвязь между метаболическими данными ПЭТ/КТ с 18F-FDG до лечения и ответом на лечение у пациентов с раком шейки матки.
Йылмаз БД,
Karyagar SS
Hell J Nucl Med
2021 янв-ап;24(1):18-24.
Epub 2021 20 апр
дои: 10.1967/s002449912302.
PMID: 33866335
Существует ли корреляция между ВПЧ и ранним лучевым ответом до брахитерапии при карциноме шейки матки?
Йылмаз БД,
Уйсал Е,
Гурдал Н,
Озкан А
Радиол Мед
2020 Октябрь; 125 (10): 981-989.
Epub 2020 10 апр
doi: 10.1007/s11547-020-01187-x.
PMID: 32277333
Распространение инфекций, вызванных вирусом папилломы человека, шейки матки среди женщин репродуктивного возраста — поперечное исследование, проведенное в больнице на северо-востоке Индии.
Сарма У,
Маханта Дж,
Боркакоты Б,
Sarmah B
Asian Pac J Рак Предыдущая
2015;16(4):1519-23.
doi: 10.7314/apjcp.2015.16.4.1519.
PMID: 25743824
Посмотреть все (179)
Руководство по клиническому прогнозированию
Вирус папилломы человека Инфекция шейки матки и спектр патологии шейки матки при вирусе иммунодефицита человека/СПИДе.
Джейн Б.Б.,
Адхикари Т,
Садхухан ПК,
Nandi A
J Рак Res Ther
2021, октябрь-декабрь; 17 (6): 1462-1467.
doi: 10.4103/jcrt.JCRT_552_19.
PMID: 34916378
Взаимосвязь между метаболическими данными ПЭТ/КТ с 18F-FDG до лечения и ответом на лечение у пациентов с раком шейки матки.
Йылмаз БД,
Karyagar SS
Hell J Nucl Med
2021 янв-ап;24(1):18-24.
Epub 2021 20 апр
дои: 10.1967/s002449912302.
PMID: 33866335
Не связанные с вирусом папилломы человека аденокарциномы шейки матки. Цитологические особенности и диагностическое согласие с использованием цифровой цитологической визуализации всего предметного стекла.
Негри Г.,
Мачоку Э,
Цепурнайте Р,
Касал А,
Тронконе Г,
Стейнкассер М,
Vittadello F
Диагност Цитопатола
2021 фев; 49 (2): 316-321.
Epub 2020 Окт 29
doi: 10.1002/dc.24652.
PMID: 33118707
Существует ли корреляция между ВПЧ и ранним лучевым ответом перед брахитерапией при карциноме шейки матки?
Йылмаз БД,
Уйсал Е,
Гурдал Н,
Озкан А
Радиол Мед
2020 Октябрь; 125 (10): 981-989. Epub 2020 10 апр
doi: 10.1007/s11547-020-01187-x.
PMID: 32277333
Epub 2020 10 апр
doi: 10.1007/s11547-020-01187-x.
PMID: 32277333
Себорейные кератозоподобные поражения шейки матки и влагалища: сообщение о новом субъекте, возможно связанном с папилломавирусной инфекцией человека низкого риска.
Талия КЛ,
McCluggage WG
Am J Surg Pathol
2017 Апрель; 41 (4): 517-524.
дои: 10.1097/ПАС.0000000000000762.
PMID: 27792064
Просмотреть все (225)
Эффективность вакцинации для предотвращения инфицирования вирусом папилломы человека при анальном и оральном контакте: систематический обзор и метаанализ.
Чжан Дж.,
Цинь З,
Лу С,
Хуан Дж,
Xiong Y
Общественное здравоохранение
2021 июль; 196: 165-171.
Epub 2021 3 июля
doi: 10.1016/j.puhe.2021.05.012.
PMID: 34229128
Диагностическая точность нового окрашивающего раствора, опосредованного фолатными рецепторами (FRD), для CIN2+: систематический обзор и метаанализ.
Ли YX,
Ло ХС,
Ван В,
Ван З,
Чжао В.Х.,
Hao M
Медицина (Балтимор)
2021 21 мая;100(20):e26004. doi: 10.1097/MD.0000000000026004.
PMID: 34011097Free PMC Article
doi: 10.1097/MD.0000000000026004.
PMID: 34011097Free PMC Article
Преобладание подгенотипов вируса папилломы человека после плоскоклеточного рака головы и шеи на азиатском континенте, статья в систематическом обзоре.
Бухари Н,
Джозеф Дж.П.,
Хусейн С.С.,
Хан М.А.,
Ваким MJY,
Яхья ЭБ,
Ариф А,
Салим А,
Sharif N
Asian Pac J Рак Предыдущая
2019 1 ноября; 20 (11): 3269-3277.
дои: 10.31557/APJCP.2019.20.11.3269.
PMID: 31759348Free PMC Article
Фактические данные о распространенности, заболеваемости, смертности и тенденциях раковых заболеваний, связанных с вирусом папилломы человека, в странах Африки к югу от Сахары: систематический обзорный обзор.
Лекоане КМБ,
Куупиль Д,
Машамба-Томпсон Т.П.,
Гининдза TG
BMC Рак
2019 11 июня; 19 (1): 563.
doi: 10.1186/s12885-019-5781-3.
PMID: 31185951Free PMC Article
Вирус папилломы человека, связанный с раком ротовой полости, и профилактические стратегии: роль вакцин.
Оттрия Л,
Кандотто В,
Кура Ф,
Багги Л,
Аркури С,
Нардоне М,
Гаудио РМ,
Гатто Р,
Спадари Ф,
Carinci F
J Biol Regul Homeost Агенты
2018 янв-февраль;32(2 Дополнение 1):61-65. PMID: 29460519
PMID: 29460519
См. All (7)
Схема патологии — плоскоклеточная папиллома
Плоковая папиллома
Последний автор Обновление: 1 август 2017
Последний персонал Обновление: 30 апреля 20119
. 2003-2022, PathologyOutlines.com, Inc.
Поиск в PubMed: Плоскоклеточная папиллома шейки матки
Просмотров страниц в 2021 году: 7 756
Просмотров страниц в 2022 году на сегодняшний день: 5 290
Процитируйте эту страницу: Li Z. Плоскоклеточная папиллома. Сайт PathologyOutlines.com. https://www.pathologyoutlines.com/topic/cervixsquamouspapilloma.html. По состоянию на 2 ноября 2022 г.
Определение / общее
- Доброкачественное полиповидное образование, состоящее из одной папиллярной ветви с центральным фиброваскулярным ядром и зрелым плоским эпителием
Основные признаки
- Состоит из одной папиллярной ветви с центральным фиброваскулярным ядром и зрелым плоским эпителием без сложной ветвящейся архитектуры, акантоза или клеточной атипии (койлоциты)
Эпидемиология
- Обычно женщины репродуктивного возраста
Места
- Нижние отделы половых путей (влагалище, вульва, реже шейка матки)
Этиология
- Не связанный с ВПЧ-инфекцией
- Предрасполагающие факторы неизвестны
Клинические признаки
- Обычно бессимптомны, но могут сопровождаться жжением или диспареунией
Диагноз
- Состоит из одной папиллярной ветви с центральным фиброваскулярным ядром и зрелым плоским эпителием
- Отсутствие сложной ветвящейся архитектуры, акантоза и клеточной атипии койлоцитов
Лечение
- Иссечение лечебное
Общее описание
- Могут быть одиночные или множественные полиповидные поражения, обычно 5 мм или менее
Микроскопическое (гистологическое) описание
- Состоит из одной папиллярной ветви с центральным фиброваскулярным ядром и зрелым гиперпластическим плоским эпителием
- Отсутствие признаков койлоцитов: сложная древовидная архитектура, акантоз, клеточная атипия, митоз
Описание цитологического исследования
- Обычно отрицательный результат на аномальные/атипичные клетки
Дифференциальный диагноз
- Полип шейки матки/эндоцервикальный: покрыт однослойным плоским эпителием или железистым эпителием
- Кондиломы: сложная древовидная архитектура, акантоз, койлоцитоз; Ki67 и HPV IHC могут быть полезны (Am J Surg Pathol 2000; 24: 1393, Am J Surg Pathol 2013; 37: 300)
- Папиллярная незрелая метаплазия
- Веррукозная карцинома: выраженная клеточная атипия с митозом, характер роста раздвигающих границ
- Высокодифференцированный плоскоклеточный рак: выраженная клеточная атипия с митозом, инфильтративный характер роста со стромальной реакцией
Вопрос в стиле обзора Совета № 1
- Что из следующего верно в отношении плоскоклеточной папилломы:
- Обычно имеет сложную ветвящуюся архитектуру и акантоз.