Домашняя практическая работа по физике «Скорость диффузии»
Домашняя практическая работа по физике
Проведение опытов по обнаружению зависимости между скоростью движения частиц и температурой.
Цель работы: выявить зависимость между скоростью движения частиц и температурой.
Оборудование: три стакана, секундомер, вода при t~100C, вода при t~10C, кристаллы марганцовки, снег.
Ход работы:
Имеется три стакана:
Со снегом
С горячей водой
С холодной водой
Одновременно во все стаканы опустим одинаковое количество кристаллов марганцовки.
С течением времени наблюдаем диффузию. После первой минуты опыта мы можем заметить, что в стакане со снегом пятно от кристалла увеличилось. В стакане с горячей воде кристалл опустился на дно, и вода окрасилась в бледно-малиновый цвет. В стакане с холодной воде остался видимый след от перемещения кристалла.
На седьмой минуте эксперимента перемешаем растворы (принудительная диффузия).
На десятой минуте завершаем эксперимент. Ярче всего окрасился раствор в стакане с горячей водой. Так же в этом растворе не осталось никакого осадка. В стакане с холодной водой сохранился осадок. По мере таянья снега в третьем стакане диффузия в создающейся жидкости проходила быстрее.
Вывод: Скорость движения частиц зависит от многих факторов. Мы увидели, что лучше и быстрее всех реакция прошла в стакане с горячей водой. Значит, скорость диффузии зависит от температуры. Чем выше температура, тем больше скорость движения частиц. Так же скорость зависит от агрегатного состояния. Пока в стакане №1 был снег, диффузия шла медленно, но по мере таяния скорость диффузии увеличивалась. Так как в веществе, находящемся в твердом состоянии, частицы совершают колебания около положения равновесия, расстояние между ними меньше, чем в жидком состоянии.
поминальные и похоронные традиции и ритуалы на Руси.
Проводы человека в мир иной чтились на Руси не меньше, чем его появление на свет. Мы расскажем вам о самых необычных похоронных обрядах, о которых ученые узнали из этнографических экспедиций. Некоторые из этих ритуалов соблюдаются и по сей день.
Марганцовка, яйца и «магическое» мыло
Леонид Соломаткин. После похорон. 1869
В селе Средней Сухоны Вологодской области был популярен обычай приготовления к смерти. Старики заранее готовили себе смертную одежду, высказывали пожелания, где и как их похоронить, каким образом поминать.
Для лучшей сохранности тела умершего под стол или лавку ставили таз с холодной водой, в которой растворяли марганец. Около ушей покойного клали сырые яйца, которые во время захоронения бросали в могильную яму.
Здесь существовало поверье, что мыло после обмывания покойного приобретает магические свойства. Его хранили и использовали в дальнейшем болезней у людей и животных. При заболевании рук — мыли им руки и приговаривали: «Человек ушёл, у него ничего не болит, и у меня ничего не заболит».
Ночевка над покойником, «откупливание» нового места жительства
Василий Перов. Проводы покойника. 1865
В деревне Черёмуха Брянской области было принято ночью сидеть/ночевать над покойником — ходить на хавтуры. В сидениях обычно участвовали пожилые женщины, многие из которых знали церковные молитвы. Сюда приходили без приглашения. В шесть утра усопшему открывали лицо и умывали святой водой, женщины выходили на улицу и голосили.
На кладбище в могилу, которую обязательно выкапывали чужие люди, перед опусканием гроба бросали монетки — «откупливали» место. Здесь же устраивали поминальную трапезу, постелив на могилу небольшое полотенце — постельку — и скатерть, которые затем уносили домой. До наступления 40-го дня после смерти скатерть нельзя было стирать, а постельку после 40 дней отдавали в церковь.
«Плохая» вода, крапива и металлические предметы
Марк Шагал. Покойник. 1908
Покойник. 1908
В села Новосолдатка Воронежской области обмывали и обряжали покойника по истечении двух часов после смерти. Мыть умершего могли как родственники, так и чужие люди, существовал запрет только на обмывание детьми своей матери. Считалось, что эта вода приобретала особые свойства, прикосновение к ней могло негативно сказаться на человеке, поэтому ее выливали в такие места, где люди не могли бы на нее наступить, например под забор.
Умершего человек клали на лавку и связывали руки и ноги. Развязывали их только на кладбище, перед тем как опускать гроб в могилу. Над покойником совершали магические действия, чтобы дольше сохранить тело. Например, под лавку, на которой лежал покойник, обязательно клали какой-нибудь металлический предмет (чаще всего — топор или замок), обкладывали умершего крапивой.
Читайте также:
Ночью, пока покойник находился в доме, не разрешалось спать. В полночь устраивали поминальную трапезу, по окончании которой лицо покойника закрывали. По традиционным представлениям это связано с тем, «что если его не накрыть, то он не будет спать, а будет беспокоить живых».
Длина ног, сожженная солома и причитания
Василий Перов. Возвращение крестьян с похорон зимою. 1880-е
В Осиновице, что в Смоленской области, сравнивали длину ног покойника: если у него длиннее левая нога — следующей в деревне умрет женщина, а если правая — мужчина.
Под голову умершему подкладывали подушечку, которую набивали сухой листвой из березовых веников. Клали покойника на лавку на солому, застеленную белым льняным полотном. После похорон эту солому уносили в поле и сжигали, наблюдая, куда пойдет дым: «Если на дом, то хорошо, а если в поля, то, говорят, что всё потянет за собой, в доме будет плохо, пустота».
После того как умершего обмоют и положат на лавку, начинали причитать — голосить. Но на исполнение причитаний налагались определенные запреты. Нельзя было голосить в темное время суток и особенно ночью. Не должны были голосить беременные женщины, «а то ребёнок будет беспокойный».
«Приказывания» и белые платки
Алексей Корзухин. Поминки на кладбище. 1865
Одна из локальных этнографических групп русского населения, которая привлекала внимание исследователей еще в ХIХ веке, — горюны. Они проживали в западной части Курского Посемья, в Путивльском (а ранее и в Белопольском) районах Сумской области Украины. Эта территория до 1925 года входила в состав Курской губернии.
К наиболее специфическим особенностям погребальной традиции горюнов относятся обычай захоронения умерших в садах, в пределах места проживания.
Кроме того, в оплакивании покойника участвуют всех женщины села. Громкие похоронные причитания оповещали всех жителей о смерти односельчанина. Обмытого и одетого покойника клали на лавку, мужчин — к передней стене дома, а женщин — к правой боковой, выходящей на двор. Причитать — или, как здесь говорили, приказывать — начинали с порога, когда приходили в дом, чтобы попрощаться с покойником. В теплое время года жительницы по старинному обычаю приходили на похороны в белых платках.
«Чтеи» и духовные стихи
Карл Фридман. Похороны. 1966
Основным музыкально-фольклорным жанром современных похоронно-поминальных обрядов в деревне Епихино Шатурского района являются духовные стихи. Они поются поочередно с чтением Псалтири до похорон («пакойника аднаво не аставляли, всё эта вот и читали»), на «девятинки» (девятый день), «сороковой день», «полгода» и на «годину» (год) со дня кончины.
Хранители духовных стихов — женщины старшего возраста (от 60 лет). В быту их называют «чтеями», «читалками» или «духовными» («когда соберутся духовные, они не обсуждают, что там в мире творится, а всё про Бога поют», а сами стихи — «божественными песнями», иногда — «стишками».
Занимательные опыты
Почему чернеют фруктовые ножи?!
Почему чернеют фруктовые ножи
Если добавить к какому-нибудь фруктовому соку раствор соли железа (раствор соли железа можно легко получить в домашних условиях, если в медный купорос опустить на полчаса, например, гвоздь или несколько кнопок, скрепок), то жидкость сразу потемнеет. Мы получим раствор слабых чернил. Фрукты содержат дубильную кислоту, которая с солью железа образует чернила.
Для того чтобы получить раствор соли железа дома, опустите гвоздь в раствор медного купороса и подождите минут десять. Потом слейте зеленоватый раствор. Полученный раствор сульфата железа (FeSO4) можно использовать в реакциях.
Мы получим раствор слабых чернил. Фрукты содержат дубильную кислоту, которая с солью железа образует чернила.
Для того чтобы получить раствор соли железа дома, опустите гвоздь в раствор медного купороса и подождите минут десять. Потом слейте зеленоватый раствор. Полученный раствор сульфата железа (FeSO4) можно использовать в реакциях.
Чай тоже содержит дубильную кислоту. Раствор соли железа, добавленный в слабый раствор чая, изменить окраску чая на чёрную. Именно по этому не рекомендуется заваривать чай в металлическом чайнике!
Химические реакции с поваренной солью
Иногда поваренную соль специально йодируют, т. е. добавляют к ней иодиды натрия или калия. Делается это потому, что йод входит в состав различных ферментов в организме, и при его недостатке ухудшается работа щитовидной железы.
Растворы медного купороса с поваренной солью (зелёного цвета)Обнаружить добавку достаточно просто. Нужно сварить крахмальный клейстер: четверть чайной ложки крахмала развести в стакане холодной воды, нагреть до кипения, кипятить пять минут и охладить. Клейстер значительно более чувствителен к йоду, чем сухой крахмал. Далее треть чайной ложки соли растворяют в чайной ложке воды, в полученный раствор добавляют несколько капель уксусной эссенции (или половину чайной ложки уксуса), половину чайной ложки перекиси водорода и через две-три минуты — несколько капель клейстера. Если соль была йодирована, то перекись водорода вытеснит свободный иод:
2I—+ Н2О2+2СН3СООН→ I2+2Н2О+2СН3СОО—,
который окрасит крахмал в синий цвет. (Опыт не получится, если для иодирования соли использовали KClO3 вместо KI).
Можно провести опыт с медным купоросом и поваренной солью. Здесь не будет происходить ни одна из вышеперечисленных реакций.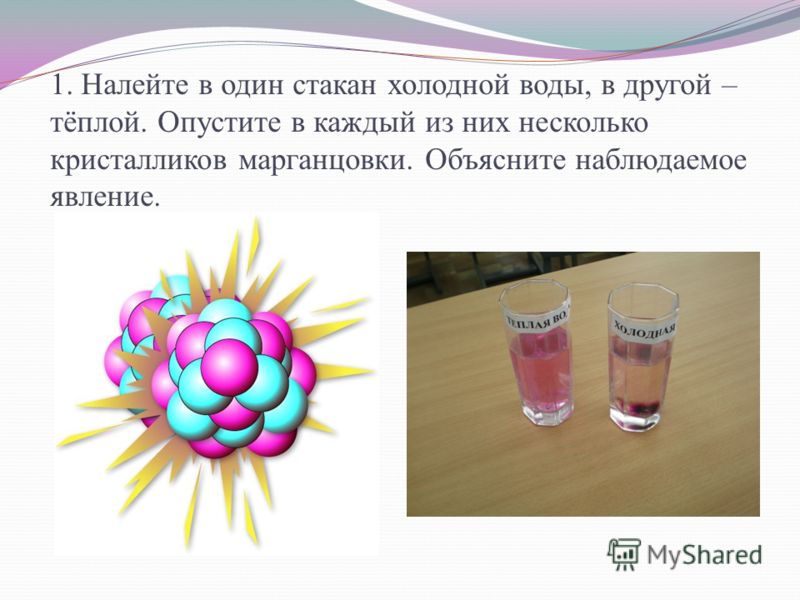 Но реакция красивая… При смешивании купороса и соли наблюдайте образование красивого зелёного раствора тетрахлорокупрата натрия Na2[CuCl4]
Но реакция красивая… При смешивании купороса и соли наблюдайте образование красивого зелёного раствора тетрахлорокупрата натрия Na2[CuCl4]
Занимательные опыты с марганцовкой:
Растворите в воде несколько кристалликов перманганата калия и подождите некоторое время. Вы заметите, что малиновая окраска раствора (объясняемая наличием перманганат-ионов в растворе) постепенно станет более бледной, а затем и совсем исчезнет, на стенках же сосуда образуется коричневый налёт оксида марганца (IV):
4КMnО4+2Н2О→ 4MnO2+4КОН+3О2
Посуду, в которой вы проводили опыт, легко очистить от налёта раствором лимонной или щавелевой кислоты. Эти вещества восстанавливают марганец до степени окисления +2 и переводят его в растворимые в воде комплексные соединения. В тёмных склянках растворы перманганата калия могут сохраняться годами. Многие считают, что перманганат калия хорошо растворим в воде. На самом деле растворимость этой соли при комнатной температуре (20 °С) составляет всего 6,4 г на 100 г воды. Однако раствор имеет настолько интенсивную окраску, что кажется концентрированным.
Если нагреть марганцовку до 200 0C, то перманганат калия превратится в тёмно-зелёный манганат калия (К2MnO4). При этом выделяется большое количество чистого кислорода, который можно собрать и использовать для других химических реакций. Особенно быстро раствор марганцовки портится (распадается) в присутствии восстановителей. Например, восстановителем является этиловый спирт C 2H5OH. Реакция марганцовки со спиртом протекает следующим образом:
2КMnO4+3C2H5OH→ 2KOH+2MnO2+3CH3CHO+2H2O.
Моющее средство из марганцовки:
Для того чтобы получить самодельное «моющее средство», надо смешать марганцовку с кислотой. Конечно, не со всякой. Некоторые кислоты могут сами окисляться; в частности, если взять соляную кислоту, из неё выделится ядовитый хлор:
Конечно, не со всякой. Некоторые кислоты могут сами окисляться; в частности, если взять соляную кислоту, из неё выделится ядовитый хлор:
2КMnO4+16HCl→ 2MnCl2+5Cl2+2KCl+8Н2О.
Так его часто и получают в лабораторных условиях. Поэтому для наших целей лучше использовать разбавленную (примерно 5-процентную) серную кислоту. В крайнем случае её можно заменить разбавленной уксусной кислотой — столовым уксусом. Возьмём примерно 50 мл (четверть стакана) раствора кислоты, добавим 1—2 г перманганата калия (на кончике ножа) и тщательно перемешаем деревянной палочкой. Затем промоем её под струёй воды и привяжем к концу кусок поролоновой губки. Вот этой «кисточкой» быстро, но аккуратно размажем окислительную смесь по загрязнённому участку раковины. Вскоре жидкость начнёт менять цвет на тёмно-вишнёвый, а затем — на коричневый. Значит, реакция окисления пошла полным ходом.
Здесь необходимо сделать несколько замечаний. Работать надо очень осторожно, чтобы смесь не попала на руки и одежду; хорошо бы надеть клеёнчатый фартук. И не следует медлить, так как окислительная смесь очень едкая и со временем «съедает» даже поролон. После использования поролоновую «кисть» нужно погрузить в заранее приготовленную банку с водой, промыть и выбросить. Во время подобной очистки раковины может появиться неприятный запах, издаваемый продуктами неполного окисления органических загрязнений на фаянсе и самой уксусной кислоты, поэтому помещение должно проветриваться.
Минут через 15—20 смоем побуревшую смесь струёй воды. И хотя раковина предстанет в ужасном виде — вся в бурых пятнах, волноваться не стоит: продукт восстановления перманганата калия — диоксид марганца MnO
А вот когда перманганат калия взаимодействует с концентрированной серной кислотой, образуется оксид марганца (VII) Mn2О7 — маслянистая тёмно-зелёная жидкость. Это единственный жидкий при нормальных условиях оксид металла (tпл=5,9°С). Он очень неустойчив и легко взрывается при незначительном нагревании (tразл=55°С) или при сотрясении. Mn
Это единственный жидкий при нормальных условиях оксид металла (tпл=5,9°С). Он очень неустойчив и легко взрывается при незначительном нагревании (tразл=55°С) или при сотрясении. Mn
Занимательные опыты с перекисью водорода
Пероксид водорода может быть как окислителем (это его свойство широко известно), так и восстановителем! В последнем случае он реагирует с веществами-окислителями:
Н2О2-2е→ 2Н++О2. Диоксид марганца как раз и является таким веществом. Подобные реакции химики называют «восстановительным распадом пероксида водорода».
Вместо аптечной перекиси можно использовать таблетки гидроперита — соединения пероксида водорода с мочевиной состава CO(NH2)2•Н2О2. Это не химическое соединение, поскольку между молекулами мочевины и пероксида водорода нет химических связей; молекулы Н 2О2 как бы включены в длинные узкие каналы в кристаллах мочевины и не могут выйти оттуда, пока вещество не растворят в воде. Поэтому такие соединения называют канальными соединениями включения. Одна таблетка гидроперита соответствует 15 мл (столовой ложке) 3-процентного раствора Н2О2. Для получения 1-процентного раствора Н2О2 берут две таблетки гидроперита и 100 мл воды.
Используя диоксид марганца в качестве окислителя пероксида водорода, нужно знать одну тонкость. MnO2 — хороший катализатор реакции разложения Н2О2 на воду и кислород:
2Н2О2→ 2Н2О+О2.
И если просто обработать раковину раствором Н2О2, то он мгновенно «вскипит», выделяя кислород, а бурый налёт так и останется, ведь катализатор в ходе реакции и не должен расходоваться.
MnO2+Н2О2+2Н+→ Mn2++2Н2О+О2.
Остаётся только смыть хорошо растворимую соль марганца струёй воды. Таким же способом можно попробовать почистить загрязнённую алюминиевую сковороду: в присутствии сильных окислителей на поверхности этого металла образуется прочная защитная плёнка оксида, которая предохранит его от растворения в кислоте. А вот чистить подобным методом эмалированные изделия (кастрюли, ванны) не стоит: кислая среда медленно разрушает эмаль. Для снятия налёта MnO 2 можно использовать также водные растворы органических кислот: щавелевой, лимонной, винной и др. Причём специально подкислять их не понадобится — кислоты сами создают в водном растворе достаточно кислую среду.
Занимательные опыты
Химическая реакция между йодидом калия и уксуснокислым в свинцом«Золото» в колбе
Конечно, золото — не настоящее, но опыт красивый! Для Химической реакции нам потребуется растворимая соль свинца (подойдёт уксуснокислый синец (CH3COO)2Pb- соль образованная растворение свинца в уксусной кислоте) и соль йода (например, йодид калия KI). Уксуснокислый свинец можно получить и в домашних условиях, опустив кусочек свинца в уксусную кислоту. Йодид калия иногда используют для травления электронных плат
Йодид калия и уксуснокислый в свинец — две прозрачные жидкости, по внешнему виду не отличаются от воды.
Начнём реакцию: к раствору йодида калия прилейте раствор уксуснокислого свинца. Соединяя две прозрачные жидкости наблюдаем образование золотисто-жёлтого осадка — йодида свинца PbI2, — эффектно!
Реакция протекает следующим образом:
Соединяя две прозрачные жидкости наблюдаем образование золотисто-жёлтого осадка — йодида свинца PbI2, — эффектно!
Реакция протекает следующим образом:
(CH3COO)2Pb+KI→ CH3COOK+PbI2
Занимательные опыты с канцелярским клеем
Канцелярский клей — это не что иное, как жидкое с текло или его химическое название «силикат натрия» Na2SiO3 Можно сказать также — это соль натрия кремниевой кислоты. Если добавить к силикатному клею раствор уксусной кислоты, в осадок выпадет нерастворимая кремниевая кислота — гидратированный оксид кремния:
Na2SiO3+2СН3СООН→ 2CH3COONa+H2SiO3.
Полученный осадок H2SiO3 можно высушить в духовке и развести разбавленным раствором водорастворимых чернил. В результате чернила осядут на поверхности оксида кремния, и смыть их не удастся. Такое явление называется адсорбцией (от лат. ad — «на» и sorbeo — «поглощаю»)
Ещё один красивый занимательный опыт с жидким стеклом. Нам понадобятся медный купорос CuSO4, сульфат никеля NiS04, хлорид железа FeCl3. Сделаем химический аквариум. В высокую стеклянную банку с силикатным клеем, разбавленным пополам водой, одновременно из двух стаканов выливают разбавленные водные растворы сульфата никеля и хлорида железа. В банке постепенно вырастают силикатные «водоросли» жёлто-зелёного цвета, которые, переплетаясь, опускаются сверху вниз. Теперь добавим в банку по каплям раствор медного купороса, заселим аквариум «морскими звёздами». Рост водорослей — это результат кристаллизации гидроксидов и силикатов железа, меди и никеля, которые образуются в результате обменных реакций.
Занимательные опыты с йодом
Добавим к йодной настойке несколько капель перекиси водорода H2O2 и перемешаем. Через некоторое время из раствора выделится чёрный поблёскивающий осадок. Это кристаллический йод — плохо растворимое в воде вещество. Иод выпадает быстрее, если раствор немного подогреть горячей водой. Перекись нужна для того, чтобы окислить содержащийся в настойке иодид калия KI (его добавляют, с целью увеличить растворимость иода).
С плохой растворимостью иода в воде связана и другая его способность — экстрагироваться из воды жидкостями, состоящими из неполярных молекул (маслом, бензином и т.д.). В чайную ложку воды добавим несколько капель подсолнечного масла. Перемешаем и увидим, что масло с водой не смешивается. Если теперь туда капнуть две-три капли йодной настойки и сильно встряхнуть, то слой масла приобретёт тёмно-коричневую окраску, а слой воды — бледно-жёлтую, т.е. большая часть йода перейдёт в масло.
Через некоторое время из раствора выделится чёрный поблёскивающий осадок. Это кристаллический йод — плохо растворимое в воде вещество. Иод выпадает быстрее, если раствор немного подогреть горячей водой. Перекись нужна для того, чтобы окислить содержащийся в настойке иодид калия KI (его добавляют, с целью увеличить растворимость иода).
С плохой растворимостью иода в воде связана и другая его способность — экстрагироваться из воды жидкостями, состоящими из неполярных молекул (маслом, бензином и т.д.). В чайную ложку воды добавим несколько капель подсолнечного масла. Перемешаем и увидим, что масло с водой не смешивается. Если теперь туда капнуть две-три капли йодной настойки и сильно встряхнуть, то слой масла приобретёт тёмно-коричневую окраску, а слой воды — бледно-жёлтую, т.е. большая часть йода перейдёт в масло.
Йод — весьма едкое вещество. Чтобы убедиться в этом, несколько капель йодной настойки поместим на металлическую поверхность. Через некоторое время жидкость обесцветится, а на поверхности металла останется пятно. Металл прореагировал с иодом с образованием соли — йодида. На этом свойстве иода основан один из способов нанесения надписей на металл.
Цветной занимательный опыт с аммиаком
Под веществом «аммиак» мы подразумеваем водный раствор аммиака (нашатырный спирт). На самом же деле — аммиак — это газ, при растворении в воде который образует новый класс химических соединений — «основания». Именно с основанием мы и будем экспериментировать. Эффектный опыт можно проделать с раствором аммиака (нашатырным спиртом). Аммиак образует с ионами меди окрашенное соединение. Возьмите бронзовую или медную монету с тёмным налётом и залейте её нашатырным спиртом. Сразу или через несколько минут раствор окрасится в синий цвет. Это под действием кислорода воздуха медь образовала комплексное соединение — аммиакат:
2Cu+8NH3+3Н2О+О2→ 2[Cu(NH3)4(H2O)2](OH)
Занимательные опыты: гашение извести
Гашение извести — это химическая реакция между оксидом кальция (СaO — негашеная известь) и водой. Она протекает следующим образом:
CaO + H2O→ Ca(OH)2.
Гидроксид кальция (Ca(OH)2) ещё называется известковым молоком . Если через раствор гидроксида кальция пропустить углекислый газ (или подышать в трубочку через раствор), то выпадет белый нерастворимый осадок карбоната кальция:
Ca(OH)2 + CO2→ CaCO3 + H2O.
Эта реакция также является качественной реакцией на ионы кальция Ca+ в растворе. Образующееся вещество — карбонат кальция — это всем известный мел (извёстка, цветные мелки)
Первая помощь кошке и коту: при отравлении, при падении с высоты
В Вашем доме живет пушистый любимец и радует Вас своими веселыми играми, ласками и мурчаниями каждый день.
Мягкий комочек прыгает тут и там, пролазит в разные уголки Вашей квартиры, исследует пространство вокруг себя. Этот любопытных нрав позволяет кошке познавать мир, наслаждаясь его разнообразием.
Кошка живет с интересом, каждый день таит в себе новые приключения и открытия. Но на пути своих приключений кошка может встретиться с опасностью даже в ограниченном пространстве маленькой квартиры.
Первая помощь кошке будет описана в этой статье. Вы узнаете, как оказать кошке первую помощь в разных неприятных ситуациях, которые могут с ней случиться. Первая помощь кошке является ключевой, от того насколько качественно и своевременно будет оказана первая помощь кошке зависит ее здоровье, а в некоторых случаях и сама жизнь!
Пословица говорит, что у кошки девять жизней, да, организм кошки обладает удивительными способностями к регенерации, но в некоторых сложных случаях кошке может потребоваться профессиональная помощь ветврача. Поэтому Вам обязательно нужно узнать заранее, где находится ближайшая к Вам ветеринарная клиника, узнать выезжает ли экстренная помощь на место. Если да, то обязательно напишите телефонный номер экстренной помощи в свой блокнот или повесьте на видное место, чтобы Вам не пришлось долго искать телефонный номер, когда каждая минута промедления может оказаться решающей!
Если да, то обязательно напишите телефонный номер экстренной помощи в свой блокнот или повесьте на видное место, чтобы Вам не пришлось долго искать телефонный номер, когда каждая минута промедления может оказаться решающей!
Первая помощь кошке может потребоваться в различных ситуация, рассмотрим их подробнее.
Первая помощь кошке при отравлении
Одной из самых распространенных неприятностей, которая может приключиться с Вашим питомцем является отравление.
Отравление кошки может быть вызвано различными причинами, в зависимости от причины отравления проводится и соответствующая первая помощь кошке при отравлении.
Отравление кошки может произойти как по причине попадания в организм кошки вредных отравляющих веществ, так и по причине попадания испорченных продуктов.
Отравление может наступить не только от съедания кошкой вредных веществ, но и по причине вдыхания ядовитых веществ или слизывания их с поверхности своей шерсти.
При отравлениях необходимо срочно показать питомца ветеринару, но до поездки в ветлечебницу необходимо оказать первую помощь кошке при отравлении.
Ваши действия должны напрямую завесить от причин отравления.
Так, если причиной отравления кошки стали ядовитые газы, дым и испарения растворителей, то симптомами отравления будут: отдышка, вялость, рвота, слюнотечение, судороги и потеря сознания.
Ваши действия в этом случае: перенести питомца на свежий воздух, высвободить дыхательные пути кошки, попробовать привести кошку в чувства с помощью ватного тампона, смоченного в нашатырном спирте, если животное не реагирует необходимо провести процедуру искусственного дыхания.
Для этого животное должно лежать на ровной поверхности на правом боку, Вы должны вытащить язык из пасти вперед и вбок. Нужно плотно приложить свои губы к носу кошки и интенсивно выдыхать ей в ноздри. От вашего выдоха грудная клетка кошки должна подниматься и потом самопроизвольно опускаться. Если подъема грудной клетки нет, то нужно выдыхать сильнее. Режим Ваших выдохов должен составлять 12-15 дыханий в минуту, или один выдох на каждые 4-5 секунд.
Если подъема грудной клетки нет, то нужно выдыхать сильнее. Режим Ваших выдохов должен составлять 12-15 дыханий в минуту, или один выдох на каждые 4-5 секунд.
Параллельно с искусственным дыханием нужно осуществлять непрямой массаж сердца. Для этого необходимо обхватить грудную клетку пальцами, при этом большой палец руки должен находится с одной стороны грудины кошки, оставшиеся пальцы — с другой стороны. Необходимо ритмичными движениями сжимать грудную клетку с интервалом 0,5 секунд. Массаж нельзя прерывать более чем на 5 секунд. Каждые 2 минуты массажа проверяйте появление пульса у кошки. Если после 20 минут Ваших манипуляций пульс не появится, то нужно прекратить массаж и искусственное дыхание, жизнь животного не удалось спасти.
Причиной отравления кошки стали вредные вещества на ее шерсти, например, краска, смола, растворитель и любые другие химикаты, которые она слизала с шерсти. Симптомы отравления в этом случае следующие: рвота, вялость, судороги, потеря сознания, остановка сердца.
В данной ситуации необходимо промыть желудок кошки и вызвать рвоту. Обязательно нужно очистить шерсть животного, для этого нанесите подсолнечное масло на место загрязнения, а затем смойте шерсть в мыльном растворе.
Помимо вышеуказанных вредных веществ кошка может отравиться лекарствами из Вашей аптечки, крысиным ядом, грызть спичечный коробок и съесть серную полоску, грызть ошейник от блох или съесть ядовитое комнатное растение.
К ядовитым комнатным и садовым растениям, которые могут причинить вред питомцу относятся: глициния, герань, фиалки, хризантемы, аспарагус, физалис, чемерица, фикусы, плющ восковидный, стапелия, лилия, ирис, физалис, ревень, филодендрон, рододендрон, календула, петунии, олеандр, тюльпаны, ландыш, жасмин, нарциссы, гиацинт, цикламен, аронники, каллы, хойя месистая, пуансеттия, клещевина, сансевьера, хлорофитум, монстера, примула, люпин, крокус, дельфиниум, кровоцвет, гипеаструм, безвременник осенний, клематис, циперус, кливия, диффенбахия, некоторые виды мака, зеленые клубни картофеля, спренгера.
Чтобы животное не ело Ваши растения, купите кошке специальную пророщенную траву в зоомагазине и уберите все опасные растения из дома или сада, где гуляет Ваш питомец.
Во всех этих случаях отравления химикатами, растениями и лекарствами необходимо вызвать рвоту.
Рвота вызывается с помощью раствора питьевой соды 1 чайная ложка на стакан воды или крепкий соляной раствор. Раствор вводится из шприца без иголки. Нужно взять одной рукой морду кошки, а другой оттянуть в сторону губу кошки, после чего в угол рта влить раствор. Желательно все эти манипуляции проводить с животным хорошо зафиксированным, для этого нужно укутать кошку в полотенце, так, чтобы ее лапы были прижаты к телу, и она не смогла бы Вас оцарапать или вырваться, чтобы убежать.
Помните, если кошка отравилась кислотой, щелочью или растворителем ей ни в коем случае нельзя вызывать рвоту. Эти вещества продолжают свое вредоносное действие и при движении из желудка обратно в пищевод это принесет дополнительные травмы.
Также нельзя вызывать рвоту, если у кошки затруднено глотание, животное без сознания испытывает сильную слабость и работа сердца ухудшилась.
Нет смысла вызывать рвоту, если с момента отправления прошло более 2 часов. В таком случаем нужно дать абсорбент, это может быть активированный уголь в количестве 1-3 таблетки, запитые 1 столовой ложкой воды.
При отравлении нужно срочно вести кошку в ветлечебницу. Если кошка отравилась лекарством, возьмите с собой упаковку этого лекарства, чтобы ветеринар мог узнать точный состав. При некоторых отравлениях у животного может наблюдаться рвота и диарея. Это может вызвать сильное обезвоживание организма, от которого кошка может умереть.
Кроме отравлений кошка может заглотнуть инородные предметы.
Если во рту у кошки застрял инородный предмет кошка трет лапой морду, кричит, дергает головой, делает жевательные движения, старается что-то проглотить или вытащить из пасти. Наблюдается кашель, удушье, слюноотделение. Откройте рот кошке, внимательно осмотрите полость рта, если Вы нашли инородный предмет постарайтесь его вытянуть с помощью пинцета. Кошка может вырываться, Вам понадобиться помощник, который будет держать пасть животного открытой.
Откройте рот кошке, внимательно осмотрите полость рта, если Вы нашли инородный предмет постарайтесь его вытянуть с помощью пинцета. Кошка может вырываться, Вам понадобиться помощник, который будет держать пасть животного открытой.
Если инородный предмет уже находится в гортани наблюдается сильный кашель, удушье и потеря сознания. Чтобы извлечь инородное тело положите кошку себе на колени. Опустите голову животному ниже крупа, резко стукните по спине и переверните животное животом вверх после чего резко надавите у края реберной дуги по направлению к грудной клетке. После этого проверьте наличие предмета во рту у кошки и сделайте искусственное дыхание в ноздри. Повторяйте эти движения пока не извлечете предмет из гортани.
Если инородное тело попало в желудок, то у кошки будет наблюдаться потеря аппетита, рвота с кровью и частичками инородного тела, сильное слюноотделение.
В этом случае нужно влить 5-6 столовых ложек растительного масла и срочно ехать к ветврачу.
Первая помощь кошке при ударе электрическим током
В квартире много источников питания электроэнергии, поэтому всегда существует опасность удара электрическим током животного.
Если кошка поражена электрическим током нужно обесточить квартиру или оттащить животное от провода одев предварительно резиновые перчатки. Если нет перчаток, возьмите сухую палку или другую вещь из непроводящих ток материалов. После этого срочно сделайте искусственное дыхание и непрямой массаж сердца.
Первая помощь кошке в случае ожогов
Нередки случаи ожогов. Ожоги могут быть химическими и термическими.
При термических ожогах паром, кипятком или огнем необходимо смочить ватный тампон в холодной и крепкой чайной заварке и промокнуть место ожога, после этого приложить к месту ожога этот тампон на 5-10 минут. После этого промокните сухой салфеткой и нанесите на место ожога мазь с антибиотиком или специальный охлаждающий спрей.
При химическом ожоге кислотой нужно промыть пораженное место большим количеством воды и приложить тампон, смоченный в растворе питьевой соды из расчета 1 чайная ложка на стакан воды.
Если ожог вызван щелочью, тогда также промойте место ожога большим количеством воды и приложите тампон, смоченный в растворе уксуса или лимонного сока, промокните место ожога и наложите повязку с мазью или спреем.
Первая помощь кошке при ушибе или растяжении
Кошки очень подвижные существа, в пылу игры они способны не заметить опасности, неудачно упасть, подвернуть лапу, вывернуться не в ту сторону. К сожалению, домашних кошек часто тянет на окно, посидеть на подоконнике, посмотреть на улицу. По недосмотру хозяев происходят несчастные случаи, когда кошка может выпасть из окна. Последствия могут быть разными, от ушибов до переломов.
Ушибы и растяжения проявляются в виде травм мягких тканей, они сопровождаются отеками и болезненными ощущениями при надавливании, может повыситься температура тела кошки. Необходимо приехать на осмотр к ветеринару, он определит нет ли перелома и других серьезных повреждений, наложит повязку, пропишет обезболивающие и расскажет, как ухаживать за травмированным животным. Не лечите животное самостоятельно, не давайте своих обезболивающих лекарств, Вы можете сильно навредить животному, ведь многие лекарства для людей могут быть опасными для здоровья кошек. Для скорого выздоровления необходимо обеспечить покой и четко выполнять все рекомендации ветеринара.
Переломы сопровождаются более сильной реакцией животного, от боли кошка может впасть в шоковое состояние вплоть до потери сознания. Сломанная конечность сильно отекает, может висеть и быть выгнутой в другую сторону, возможно удлинение или укорочение сустава. При переломе необходимо вызвать ветврача, который должен приехать и наложить шину, чтобы можно было транспортировать животное. Если вызвать ветврача нет возможности, тогда шину нужно сделать самому. Возьмите кусок плотного картона или дощечки, подходящей по размеру конечности и зафиксируйте конечность перемотав ее бинтом. При открытом переломе нужно обработать края раны дезинфектором – йодом или зеленкой.
Самыми опасными являются вывихи и переломы позвоночника, последствия нередко приводят к параличу и смерти. Самое главное – это обеспечить транспортировку животного в максимально зафиксированном виде, положив кошку на твердую ровную поверхность необходимо избегать любым резких движений, чтобы позвоночник оставался в неподвижном состоянии.
Ветеринар сделает рентген, наложит шину или гипс, а при необходимости проведет операцию.
Важным навыком для любого хозяина питомца также является умение остановить кровотечение. При открытых переломах или порезах необходимо остановить потерю крови, для этого накладывают давящую повязку. Необходимо взять ватный чисты тампон, наложить на край поврежденного сосуда и плотно зафиксировать его повязкой. Необходимо извлечь все видимые инородные предметы из раны перед наложением повязки.
Первая помощь при кровотечении
Опасно кровотечение из головы, если порез на шее, то просто прижмите тампон к месту пореза. Если кровь идет из глаз, то используйте также тампон, смоченный в холодной воде. Если из носа, тоже используйте тампон, только не перекройте кошке дыхание, она должна иметь возможность дышать носом. Из ушей кровь также перекрывается тампоном.
Теперь Вы знаете некоторые приемы оказания первой помощи кошкам. Самое главное в любой экстренной ситуации скорее обратиться к специалисту. Обязательно приобретите специальную аптечку для кошки в зоомагазине. Не забывайте содержать ее в полном порядке, меняйте вышедшие из срока годности лекарства, ведь никогда не знаешь, что может понадобиться.
Любите животных и будьте готовы оказать им первую помощь!
что делать, как правильно собрать ртуть
У меня такой вопрос: а что делать, если градусник разобьется?
Читаю на форумах — мамочки иногда пишут, что ребенок разбил градусник. Мой ведь тоже может это сделать. Как тогда быть? Вызывать МЧС или санэпидемстанцию? Расскажите, пожалуйста.
Анастасия Корнилова
мама ребенка, который разбивал градусник, ответила 08.12.2020
Я как раз из тех мам, у которых ребенок разбивал градусник. Это неприятно, но не страшно. И вызывать никого не нужно — расскажу, как действовать.
Чем опасен разбитый градусник
Пары ртути, которая содержится в наконечнике градусника и бегает по шкале, показывая температуру, опасны для здоровья. Если человек надышится ими, он отравится.
Острое отравление проявляется через несколько часов после контакта с ртутью. Среди его симптомов — общая слабость, отсутствие аппетита, головная боль и боль при глотании, металлический вкус во рту, слюнотечение, набухание и кровоточивость десен, тошнота и рвота. Нередко появляются сильные боли в животе, слизистый понос, иногда с кровью. У некоторых людей возникает воспаление легких, боли в груди, кашель и одышка, сильный озноб. Температура поднимается до +38—40 °C. Чем быстрее вы уберете ядовитое вещество из своего дома, тем больше шансов избежать отравления.
Не все стеклянные градусники одинаково ядовиты — сейчас выпускают не только ртутные, но и безртутные устройства. Например, у которых в температурной шкале находится галинстан. Это смесь жидких металлов: галлия, индия и олова. Галинстан в отличие от ртути не испаряется на открытом воздухе, поэтому безвреден для человека.
На галинстановых градусниках есть зеленая полоса. Но если возникли сомнения, была в разбитом градуснике ртуть или нет, лучше обращаться с отходами как с ядовитыми веществами. Источник: Jakye / ShutterstockКак действовать, если градусник разбился
Первым делом отправьте на прогулку или к кому-то в гости ребенка и домашних животных. Аквариум с рыбками можно оставить на месте. Если у домочадцев нет возможности уйти из дома, попросите их посидеть вместе с животными в другой комнате.
Откройте окно и закройте дверь в комнату. Ртуть начинает испаряться уже при комнатной температуре, а холод замедляет испарение. Плюс свежий воздух снижает концентрацию опасных паров. Но нельзя устраивать сквозняк, чтобы пары не переместились в другую комнату. Если на улице жарче, чем в комнате, включите кондиционер.
Плюс свежий воздух снижает концентрацию опасных паров. Но нельзя устраивать сквозняк, чтобы пары не переместились в другую комнату. Если на улице жарче, чем в комнате, включите кондиционер.
Наденьте респиратор, чтобы защититься от паров ртути, если он у вас есть. Если респиратора нет, наденьте обычную медицинскую маску или сделайте ее из бинта или марли. Перед тем как надеть самодельную маску, смочите ее водой.
Если ртуть из разбитого градусника попала на горячую батарею, убрать ее самостоятельно не получится: этот металл закипает при +40 °С, поэтому вся ртуть с радиатора сразу окажется в воздухе. В таком случае немедленно покиньте загрязненное помещение, плотно закройте дверь и позвоните в МЧС по номеру 112.
Как лечиться экономно
Или не платить за лечение вообще. Расскажем в нашей рассылке вместе с другими материалами о деньгах
Как собрать осколки и ртуть
Инструкцию, как быть, если в помещении разбился градусник, ни один закон не устанавливает. Есть инструкции на сайтах МЧС и Роспотребнадзора — я описала порядок действий с оглядкой на них и на здравый смысл.
Чтобы убраться в помещении, где разбился градусник, подготовьте такой набор приспособлений:
- Банку с закручивающейся крышкой, примерно на ⅔ заполненную холодной водой.
- Раствор марганцовки. Приготовьте его в двух вариантах: ведро густого, темно-бурого, почти непрозрачного раствора и стакан слабо-розового. В ведро на каждый литр раствора добавьте столовую ложку соли и какую-нибудь кислоту, например столовую ложку уксусной эссенции или щепотку лимонной кислоты. В нем вы будете замачивать тряпку для пола. Раствором из стакана будете полоскать рот после уборки. Если марганцовки дома нет, просто налейте в ведро холодную воду. Это разумнее, чем оставить ртуть испаряться и бежать в аптеку. Рот тоже можно прополоскать обычной водой.
- Тряпки для уборки. Они нужны, чтобы постелить на порог и вымыть место, где разбился градусник.
После уборки их придется сдать на демеркуризацию вместе с банкой с ртутью — об этом расскажу ниже.
- Лист бумаги. Он будет выполнять роль совка, на который вы будете закатывать шарики ртути.
- Шприц, медицинскую грушу, спицу, толстую иглу или канцелярский нож. Выбирайте исходя из того, что найдется у вас дома, чем вам будет удобнее собирать ртуть и с чем не жаль будет расстаться, потому что после уборки этот инструмент придется утилизировать вместе с остатками градусника.
- Кисточку для рисования или кусок ваты.
- Лейкопластырь в рулоне или скотч.
- Фонарик. Можно тот, что в телефоне.
- Бахилы и резиновые перчатки. Если нет бахил, наденьте на ноги пакеты.
Дальше действуйте так.
Наденьте на ноги бахилы, на руки — перчатки. Смочите тряпку в густом растворе марганцовки или холодной воде и постелите на пороге комнаты, где разбился градусник.
Аккуратно, чтобы не разбрызгать остатки ртути, соберите руками в перчатках осколки градусника и металлическую пластинку с делениями, опустите их в банку с водой.
Теперь займитесь ртутью. Мелкие капли можно собирать, поддевая листом бумаги, кисточкой, комком ваты или канцелярским ножом. Еще можно засасывать их шприцем или медицинской грушей. Соберите мелкие шарики в один побольше, сгоните его на бумагу и стряхните в банку с водой.
Если ртуть попала на ворсистую поверхность — ковер или ковролин, — мелкие шарики между ворсинками удобнее собрать лейкопластырем или скотчем. Потом эти клейкие кусочки с налипшей ртутью также надо отправить в банку.
Если ртуть попала в щели в полу или другие труднодоступные места, ее можно поддеть толстой иглой или спицей. Или насыпать в щель немного песка и вымести песок вместе с ртутью кисточкой. Если ртуть закатилась под плинтус, его надо демонтировать и собрать ртуть любым удобным способом.
Затем тщательно осмотрите поверхность, подсветите труднодоступные и темные места фонариком — шарики можно заметить по металлическому блеску.
Процесс уборки может затянуться. В этом случае каждые 15 минут надо делать небольшой перерыв. Можете выходить в соседнее помещение к открытому окну или на улицу.
Когда соберете ртуть полностью, все использованные предметы отправьте в ту же банку с водой и плотно закрутите крышку.
Место, где разбили градусник, промойте раствором марганцовки или холодной водой. Если градусник разбился на ковре или ковровом покрытии, лучше промыть это место водой: марганец может покрасить ворс.
Бахилы и перчатки положите в банку с водой к ртути и осколкам градусника и тщательно вымойте руки мылом. Прополощите рот слабым раствором марганцовки или водой, затем тщательно почистите зубы. В течение дня постарайтесь выпить побольше жидкости: ртутные соединения выводятся из организма с мочой.
После уборки нужно устроить в помещении сквозняк: он быстрее рассеет скопившиеся за время уборки пары ртути. И вообще, постарайтесь как можно чаще проветривать эту комнату в течение следующей недели, а заодно ежедневно в течение недели устраивать влажную уборку.
Как избавиться от банки со ртутью
Банку с ртутью нельзя выкидывать в мусорный контейнер — ее нужно отвезти в демеркуризационный центр, где принимают и уничтожают ртутьсодержащие отходы.
Если нет возможности сделать это сразу, банку можно на сутки оставить на балконе или в гараже, а потом отвезти на демеркуризацию. Лучше, чтобы в месте временного хранения ртути было прохладно.
Проще всего узнать адрес организации, которая принимает такие отходы, позвонив по телефону 112. Еще можно поискать ее в интернете, вписав в строку поиска «центр демеркуризации (название вашего населенного пункта)».
Можно отвезти банку в отделение МЧС, которое принимает на демеркуризацию особо опасные отходы. В МЧС градусники и все остальное возьмут бесплатно, в коммерческих компаниях стоимость может быть от 50 до 2000 Р. Но иногда они расположены ближе к дому и работают по более удобному графику — принимайте решение с оглядкой на эти параметры.
Чего делать нельзя
Собрать только осколки и оставить остальное. Ртуть токсична и легко испаряется. Количества ртути, которое содержится в градуснике, хватит для развития острого отравления.
Собирать осколки и шарики ртути голыми руками. Обязательно используйте перчатки и подручные средства, о которых я упоминала выше. Пары ртути могут всасываться через кожу, поэтому надо избегать контакта с этим ядовитым металлом.
Собирать ртуть веником или пылесосом. Веник только разобьет шарики ртути на более мелкие фракции и разбросает их по большей территории. А пылесос после такого использования придется сдать на уничтожение. Даже если у вас самая современная модель с улучшенными фильтрами, некоторые частицы ртути осядут в гофрированном шланге, а значит, шланг придется демеркуризировать. А если у вашего пылесоса обычные фильтры, то частицы ртути только разлетятся по комнате, пройдя сквозь нутро пылесоса, вдобавок нагревшись. То есть испарение ядовитых веществ усилится.
Выбрасывать в мусорку собранную ртуть и использованные для этого инструменты, выливать содержимое банки в канализацию.
Надеюсь, вам не пригодятся все эти советы. Но если вдруг вы попадете в такую ситуацию, то сможете быстро отреагировать и свести риск отравления к минимуму.
как отбелить в домашних условиях
Каждая хозяйка хочет видеть свой дом уютным и светлым. Зачастую занавесками в любой комнате служат тюли белого цвета, которые со времён превращаются в желтоватые. Как же избавиться от жёлтого оттенка тюли и вернуть ей неотразимую белизну и сияние?
Оказывается, отбелить тюль можно двумя способами: воспользоваться химчисткой или попробовать отбелить её дома. Самый простой вариант – воспользоваться услугами химчистки, но гарантии они никакой не дают, а денег стоит немалые. Дома тюль можно попытаться отбелить с помощью народных проверенных методов или воспользоваться уже готовыми отбеливателями, которые можно купить в любом супермаркете/магазине.
Дома тюль можно попытаться отбелить с помощью народных проверенных методов или воспользоваться уже готовыми отбеливателями, которые можно купить в любом супермаркете/магазине.
Рекомендации по технике безопасности
В любом из вариантов необходимо соблюдать элементарные правила, дабы избежать неприятных сюрпризов:
- Обязательно спрятать руки в резиновые перчатки.
- Рабочую поверхность укрыть полиэтиленом.
- Придерживайтесь инструкций и доз.
- Не стоит экспериментировать с разными способами отбеливания тюли.
- Воду использовать чистую, без хлорки.
С помощью отбеливателя (белизны)
В супермаркетах и магазинах можно найти отбеливатели (белизну) разных производителей и ценовой политике. Важно помнить одно, что отбеливатель можно применить только один раз, второй раз этот же отбеливатель не поможет избавиться от жёлтого оттенка тюлей. Чтобы отбелить тюль с помощью отбеливателя, нужно следовать инструкции, написанной на обороте бутылки. Кроме того, стоит запомнить следующее:
- Белизна разрушает тканевую структуру, применяя его регулярно можно в один момент вытащить не белоснежную тюль, а дырявую тряпку.
- Стоит внимательно прочитать инструкцию и посмотреть обозначения значков указанных на баночке-бутылочке так, как не всякую тюль можно отбеливать с помощью отбеливателя.
Отбеливать тюль с отбеливателем легко и просто берём тазик или другую ёмкость с тёплой водой. В воду добавляем белизну и погружаем в раствор тюль на час. Очень важно, чтобы тюль была полностью в воде. После истечения указанного времени, тюль стоит прополоскать. После использования белизны может появиться запах хлорки, избавиться от него поможет кондиционер для вещей или ткани.
Отбеливаем тюль вымачиванием
Этот метод не требуем особых усилий и не нужно применять белизну или другие химические средства. Перед стиркой тюли в стиральной машине или ручной стиркой, необходимо проделать следующее. Отряхнуть тюль от пыли и замочить в холодной воде. Когда вода стала серого оттенка, выкрутить тюль и поменять воду. Менять воду нужно до полной прозрачности. Только после вымачивания, можно стирать тюль с помощью стирального порошка.
Отряхнуть тюль от пыли и замочить в холодной воде. Когда вода стала серого оттенка, выкрутить тюль и поменять воду. Менять воду нужно до полной прозрачности. Только после вымачивания, можно стирать тюль с помощью стирального порошка.
В стиральной машинке
Отбеливание в стиральной машинке один из простых способов. Для этого нужен обычный стиральный порошок и две капли нашатырного спирта, если в доме его нет, подойдёт перекись водорода 5–10 таблеток. Режим Добавляем в стиральную машинку стиральный порошок с нашатырём, режим стирки выбираем деликатный, без отжима, и не выше 30 градусов. После стирки стоит прополоскать тюль в холодной воде, оттряхнуть от лишней воды и сушить привычным способом. Стоит отметить только одно – этот метод не уберёт полностью все пята на тюле, но поможет убрать жёлтый оттенок.
С помощью соли
Сняв пожелтевшую тюль с окна, не стоит торопиться её стирать. Тюль хорошенько отряхиваем от пыли и замачиваем на час в растворе. Завершающий этап – полоскание.
Капроновую тюль стоит отбеливать в чуть тёплой воде, если же вода слишком горячая – тюль сразу же пожелтеет. Затем поместить тюль в раствор из соли. Раствор готовится на десять литров воды восемь столовых ложек соли и не забыть добавить моющее средство. В этот раствор окунаем тюль и оставляем на 12 часов или на ночь. После тюль хорошо прополаскиваем и стираем обычным методом.
Есть иной вариант отбеливания тюли солью. Тюль отряхнуть от пыли, выстирать стиральным порошком, прополоскать и оставить в солевом растворе на 15 минут. Солевой раствор готовится следующим образом: на ведро тёплой воды взять пять столовых ложек соли. Солевой раствор придаст синтетической тюли не только белизну, но и сделает её немного жёсткой.
Чтобы отбелить тюль из капрона, органзы или нейлона, стоит перед стиркой замочить её в ином солевом растворе: на пять литров воды понадобиться две столовые ложки соли, которая позволит вытянуть из тюли всю грязь.
С помощью перекиси водорода
После стирки (в машинке или ручной) тюль необходимо целиком окунуть в раствор из перекиси водорода. Раствор готовится из ложки нашатыря, двух ложек перекиси и десять литров воды. Тюль необходимо полностью погрузить в раствор.Если же этого не сделать появятся жёлтые разводы в некоторых местах. Через полчаса тюль можно доставать и прополоскать в холодной воде, сушим стандартным способом.
Раствор готовится из ложки нашатыря, двух ложек перекиси и десять литров воды. Тюль необходимо полностью погрузить в раствор.Если же этого не сделать появятся жёлтые разводы в некоторых местах. Через полчаса тюль можно доставать и прополоскать в холодной воде, сушим стандартным способом.
С помощью зелёнки
Как странно не звучит, но с помощью зелёнки знающие хозяйки придают изумрудного, белого цветам своим тюлям. Раствор из зелёнки готовится следующим образом: 15 капель зелёнки растворить в стакане воды. Тщательно перемешать и оставить на пятнадцать минут. Если за это время не появиться осадок на дне стакана, значит все сделано правильно и можно приступать к отбеливанию. Но если на дне стакана появился осадок, стоит раствор переделать.
Раствор вылить в ёмкость для полоскания тюли после стирки. Тюль положить в раствор, равномерно расправив по ёмкости. После достаём тюль из раствора, отряхиваем от лишней воды и сушим.
Отбеливаем тюль марганцовкой
Ещё в старые времена у наших бабушек не было возможности приобрести белизну, поэтому они использовали то, что есть под рукой. А марганцовка была у всех, с помощью которой, они и выбеливали тюль. В наше время этот метод также сохранился. Для раствора на 15 литров воды нужно полстакана растворимой марганцовки. Все хорошенько перемешиваем. Перед тем как тюль опустить в раствор из марганцовки, её нужно натереть обычным мылом. Затем опускаем её в ведро или ёмкость с марганцовкой на 30 минут. Затем вынимаем, стираем, полощем и сушим.
С помощью синьки
Синьку нужно растворить в стакане с водой (так как и в способе с зелёнкой), если стирка ручная. Если же стирка машинная, необходимо один колпачок добавить к стиральному порошку.
Крахмалом
Ещё один способ отбеливания тюли – отбеливать крахмалом. Постиравшую тюль нужно окунуть в раствор из крахмала. После сполоснуть и посушить. Под воздействием крахмала пыль будет оседать не на сами волокна тюли, а на крахмал. И после следующей стирке грязь смоется вместе с крахмалом. Кроме того, крахмал позволит тюли держать форму.
Кроме того, крахмал позволит тюли держать форму.
Профилактика желтизны
Чтобы не ломать голову, как сделать тюль чистой и изумрудной, стоит просто не доводить её до такого состояния. Для профилактики стоит тюль стирать раз в сезон либо руками, либо в машинке. Стирать нужно стиральным порошком со специальным средством для тонких тканей, при небольшой температуре (не больше 30 градусов), тип стирки – деликатный режим. Важно помнить – горячая вода приводит к желтизне тюлей.
Мне нравится1Не нравитсяЧто делать, если в помещении разбился ртутный градусник?
2 октября 2019 г. в 12:15Если у вас дома или на работе разбился градусник, имеющий ртутный наконечник, необходимо реализовать четкий алгоритм действий по нейтрализации опасного вещества.Главное – не впадать в панику, поскольку ситуация, хоть и неприятная, но и не катастрофическая, в каждой семье такое случается.
И что еще важно, так это провести беседу с домочадцами, особенно с детьми, и объяснить, если кто-то из них разобьет градусник, нельзя это скрывать, следует тотчас рассказать взрослым или же позвонить по телефону вызова экстренных служб «101».
Ртуть, которая содержится в наконечнике градусника, является опасным для здоровья веществом. Опасными являются пары ртути (испаряется при температуре 18 С), которые в случае разбитого градусника попадают в органы дыхания человека (80%). Неправильные действия могут привести к тому, что мелкие шарики ртути будут длительное время находиться в помещении и отравлять воздух.
Итак, если в помещении разбился ртутный градусник, необходимо сделать следующее.
- Вывести людей и животных из помещения, где все это произошло, закрыть плотно дверь.
- Подготовить:
— насыщенный раствор марганцовки, а также мыльно-содовый раствор;
— банку (лучше трехлитровую) с плотной крышкой, которую наполнить холодной водой или раствором марганцовки на 2/3;
— 2 листа бумаги;
— шприц или медицинскую грушу;
— кусочек ваты или кисточку;
— вязальную спицу или шило;
— либо скотч, либо пластырь, либо изоленту;
— фонарик.
- Обуть резиновые тапочки (но не тканевые), которые не жалко выбросить или надеть на ноги полиэтиленовые пакеты. Надеть мокрую марлевую повязку на лицо (или приспособить кусок ткани) для защиты легких, а также резиновые перчатки на руки (желательно медицинские, плотно облегающие – в хозяйственных перчатках будет неудобно совершать тонкие манипуляции).
- В крепком растворе марганцовки намочить тряпку и постелить ее на порог комнаты, где разбился градусник.
- Плотно закрыть за собой дверь и открыть окно. При этом окна в других комнатах должны быть закрыты.
- Поднять градусник и все, что от него осталось, стараясь не разбрасывать оставшуюся в наконечнике ртуть, и поместить его в банку с водой.
- Аккуратно согнать мелкие шарики ртути в один большой (они будут сливаться) при помощи листов бумаги. Загнать крупные шарики на лист бумаги при помощи ваты и слить их в банку с водой.
- После того, как видимые глазу шарики ртути будут собраны, следует собрать мелкие при помощи скотча путем приклеивания его к поверхности, где разбился градусник. После обработки скотч следует отправить в банку с водой.
- Осмотреть при помощи фонарика все щели и места, куда могли закатиться шарики ртути (они будут светиться металлическим цветом). Из труднодоступных мест ртуть достается при помощи острого тонкого предмета (спицей) или всасываются в грушу или шприц. Шприц или грушу с ртутью также опустить в банку.
- Если ртуть могла закатиться под плинтус – его следует демонтировать и собрать ртуть вышеуказанными способами.
- После сбора всех капель – плотно закрыть банку крышкой.
- Пол и поверхности, где была собрана ртуть, вымыть раствором марганцовки или же мыльно-содовым раствором (можно сначала первым, затем вторым).
- Снять одежду, перчатки, маску, обувь или пакеты и сложить все в отдельный пакет, плотно завязав (их придётся выбросить).
Принять душ, рот прополоскать содовым раствором.
Ваши действия должны быть аккуратными, но в тоже время нельзя растягивать процедуру сбора ртути на часы. Ближайших 7 дней постарайтесь исключить пребывание людей и животных в этой комнате, постоянно проветривайте ее, исключив сквозняк. Каждый день необходимо мыть пол и поверхности, контактировавшие с ртутью мыльно-содовым раствором или водой с добавлением хлорсодержащего дезинфектанта.
Ближайших 7 дней постарайтесь исключить пребывание людей и животных в этой комнате, постоянно проветривайте ее, исключив сквозняк. Каждый день необходимо мыть пол и поверхности, контактировавшие с ртутью мыльно-содовым раствором или водой с добавлением хлорсодержащего дезинфектанта.
В настоящее время мероприятия по сбору токсических веществ и устранения последствий выброса их в жилое или производственное помещение осуществляют сотрудники аварийно-спасательного подразделения по Дубоссарскому району УАСС ГУпЧС МВД ПМР.
Вы можете смело набирать номер вызова экстренных служб «101» или обратиться в аварийно-спасательное подразделение города по номеру 3-37-92, вам дадут подробные инструкции о действиях, которые необходимо выполнить.
Вы можете листать страницы, используя стрелки ← и → на клавиатуре.
экспериментов с перманганатом калия | Sciencing
Перманганат калия — сильный окислитель. Стандартное промышленное использование этого соединения — очистка воды для удаления цвета, контроля вкуса и запаха и удаления железа и марганца. Перманганат калия также инактивирует некоторые вирусы и бактерии. В сочетании с органическими материалами реакция является взрывоопасной и оставляет после себя перманганатный остаток.
Окисление глицерина перманганатом калия
Этот эксперимент демонстрирует экзотермическое выделение энергии в виде тепла в результате последующей реакции.Реакция включает окисление глицерина перманганатом калия. Глицерин — органическое соединение и легко окисляемое вещество.
Вам потребуется около 20 граммов порошка перманганата калия, 3-5 миллилитров глицерина и пипетка. Вам также понадобится чистый 70-миллилитровый стакан, стеклянный утрамбовочный стержень или пробирка и защитные очки.
Зачерпните перманганат калия в стакан в хорошо проветриваемом помещении. Создайте впечатление, утрамбовывая вещество пробиркой или стеклянной палочкой.
С помощью пипетки быстро, но осторожно нанесите глицерин на слепок. Когда глицерин окисляется, в результате экзотермической реакции образуется яркое пламя.
Диффузия перманганата калия в воде
Этот эксперимент демонстрирует принцип химической диффузии с использованием перманганата калия в воде.
Вам понадобится чистый стакан на 70 мл и несколько кристаллов перманганата калия.
Поместите кристаллы на дно стакана.Постепенно добавляйте в стакан дистиллированную воду объемом до 35 миллилитров или около того. Из-за беспорядочного движения частиц перманганата калия в воде у основания стакана образуется густой раствор пурпурного цвета. Пурпурный раствор будет медленно растворяться в остальной воде по всему стакану, образуя менее плотный, но равномерно окрашенный пурпурный раствор.
Получение перманганата калия
Синтез этого соединения состоит из нескольких стадий, которые демонстрируют «окислительно-восстановительные» или окислительно-восстановительные реакции.
Вам нужно 7 граммов нитрата калия, 1 грамм диоксида марганца, 2 грамма гидроксида калия и несколько миллилитров бикарбоната натрия.
Рекомендуются защитные очки, небольшой стеклянный флакон, стакан на 50 миллилитров, небольшой молоток, ступка, пестик и вытяжной колпак.
Начните эксперимент на открытом воздухе или под вытяжным шкафом с вентиляцией. Смешайте во флаконе 7 граммов нитрата калия и 1 грамм диоксида марганца. С помощью горелки постепенно нагрейте флакон, пока два химиката не сольются вместе.Подержите расплавленную смесь в тепле несколько минут.
Добавьте к смеси 2 грамма гидроксида калия и быстро повторно нагрейте флакон до появления зеленого кипящего вещества. Продолжайте кипятить смесь в течение 5-7 минут. Снимите фонарик с кипения и дайте флакону остыть.
После того, как смесь станет твердым зеленым веществом, разбейте ее молотком на более мелкие кусочки. Используйте ступку и пестик, чтобы измельчить кусочки в порошок. Вылейте порошок в стакан и растворите в 50 миллилитрах дистиллированной воды.
Используйте ступку и пестик, чтобы измельчить кусочки в порошок. Вылейте порошок в стакан и растворите в 50 миллилитрах дистиллированной воды.
После того, как раствор станет зеленым, слейте поднявшуюся смесь доверху. Добавляйте бикарбонат натрия небольшими порциями, постоянно помешивая, пока раствор не станет пурпурным. Добавление слишком большого количества бикарбоната натрия приведет к светло-розовому цвету, что означает разрушение перманганата.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Перманганат калия | DermNet NZ
Автор: Ванесса Нган, штатный писатель, 2006 г.
Что такое перманганат калия?
Перманганат калия — окислитель с дезинфицирующими, дезодорирующими и вяжущими свойствами.Его химическая формула — KMnO 4 . Иногда его называют кристаллами Конди.
В сыром виде перманганат калия представляет собой темно-фиолетовый или почти черный кристаллический или гранулированный порошок без запаха.
Как готовится раствор перманганата калия?
Раствор перманганата калия получают растворением кристаллов или порошка в воде с целью получения раствора 1 из 10 000. Также можно использовать таблетки перманганата калия. При использовании таблеток по 400 мг добавляйте по одной на каждые 4 л воды.Таблетки следует растворить в горячей воде перед переливанием в ванну.
Раствор перманганата калия должен быть розового цвета.
Перманганат калия
Для чего используется перманганат калия?
Перманганат калия полезен при следующих дерматологических состояниях:
Ванны с перманганатом калия эффективны для лечения инфицированной экземы, когда есть волдыри, гной и / или выделения. Ванны два раза в день в течение двух дней помогают высушить мокнущие язвы и успокоить экзему.
Ванны два раза в день в течение двух дней помогают высушить мокнущие язвы и успокоить экзему.
Раствор перманганата калия можно использовать в качестве влажной пропитки для покрытых пузырями ран, таких как язвы и абсцессы. Полоски ваты или марли следует смочить в растворе и обернуть вокруг пораженного участка на 20–30 минут. Вяжущее действие перманганата калия помогает высушить волдырь и подготовить рану к другому лечению.
1% раствор (1 из 100) используется как непосредственное средство для лечения грибковых инфекций, таких как микоз.
Меры предосторожности при использовании перманганата калия
Кристаллы перманганата калия и концентрированные растворы едкие и могут вызвать ожоги кожи.Даже довольно разбавленные растворы могут вызвать раздражение кожи, а повторное использование может вызвать ожоги. Если покраснение или раздражение не исчезнут, сообщите об этом врачу. При приготовлении растворов убедитесь, что кристаллы или таблетки полностью растворились в воде перед использованием.
Перманганат калия не подходит для сухой кожи.
Обратите внимание, что перманганат калия может оставлять коричневые пятна на коже и ногтях, а также на ванне или сосуде с раствором. Перед лечением используйте лак для ногтей или нанесите мягкий парафин на ногти на руках и ногах.
Таблицы данных, утвержденные Новой Зеландией, являются официальным источником информации об этих рецептурных лекарствах, включая информацию об одобренных применениях и рисках. Ознакомьтесь с индивидуальным техническим описанием Новой Зеландии на веб-сайте Medsafe.
Список литературы
- Книга: Учебник дерматологии. Эд Рук А., Уилкинсон Д.С., Эблинг FJB, Чемпион Р.Х., Бертон Д.Л. Четвертое издание. Научные публикации Блэквелла.
- Экзема.Клинические правила здоровья детей Starship
В DermNet NZ
Другие веб-сайты
Книги о кожных заболеваниях
См. Книжный магазин DermNet NZ.
Книжный магазин DermNet NZ.
Перманганат калия — обзор
7.2.3 Окисление Ce
3 + перманганатом калияМетод окисления Ce 3 + перманганатом калия является быстрым и эффективным способом отделения диоксида церия от смешанных редкоземельных элементов. Гидроксид церия, полученный таким способом, легко фильтруется, и содержание CeO 2 может составлять 98–99% при извлечении 99%.Недостатком метода является то, что Ce (OH) 4 легко загрязняется магнием.
Реакции окисления церия перманганатом калия в слабокислом водном растворе следующие:
(7,5) 3CeNO33 + KMnO4 + 2h3O = 2CeNO34 + CeOh5 ↓ + KNO3 + Mn↓2
(7,6) CeNO34 + CeNO34 4HNO3
(7,7) HNO3 + Na2CO3 = NaNO3 + h3O + CO2 ↑
В реакции (7.5) и (7.6) Ce 3 + окисляется до Ce 4 + , а затем Ce 4 + гидролизуется с образованием Ce (OH) 4 и одновременно с образованием HNO 3 , что предотвращает дальнейшую реакцию гидролиза Ce 4 + .Следовательно, чтобы повысить уровень гидролиза всего Ce 4 + , образующегося в процессе, в реальной работе, добавляется подходящее количество нейтрализующего агента, чтобы довести pH водного раствора до 3–4 с добавлением перманганата калия для окисления Ce . 3 + в Ce 4 + . Обычно в качестве нейтрализующих агентов используют карбонат натрия и бикарбонат натрия.
Сырьем смешанных редкоземельных элементов для окисления Ce 3 + до Ce 4 + перманганатом калия может быть водный раствор нитратов редкоземельных элементов или хлоридов редкоземельных элементов.Порядок и условия эксплуатации следующие.
Водный раствор нитратов РЗЭ, содержащий 50–100 г / л REO и pH 3,5–4, нагревают в реакторе до 80–90 ° C; В раствор медленно добавляют перманганат калия для окисления Ce 3 + . В начале реакции пурпурный цвет MnO4– очень быстро исчезает с одновременным выпадением коричневого осадка. Когда водный раствор приобретает красный цвет, добавляют смешанный водный раствор карбоната натрия и перманганата калия.Мольная доля KMnO 4 к Na 2 CO 3 в смешанном водном растворе составляет 1: 4. PH нейтрализующего и окисляющего водного раствора поддерживается равным 4; содержание продукта CeO 2 может достигать 98–99%. Если pH водного раствора увеличить до 5–6, содержание CeO 2 составит всего около 95%. Если pH водного раствора устанавливается равным 1, Ce 4 + не гидролизуется полностью. Если в водном растворе остается 5% церия, содержание Ce (OH) 4 , полученного гидролизом, составляет 99% –99.9%. Процесс повторяется снова для работы с Ce (OH) 4 , и содержание Ce (OH) 4 может быть увеличено до 99,90–99,99%.
Когда водный раствор приобретает красный цвет, добавляют смешанный водный раствор карбоната натрия и перманганата калия.Мольная доля KMnO 4 к Na 2 CO 3 в смешанном водном растворе составляет 1: 4. PH нейтрализующего и окисляющего водного раствора поддерживается равным 4; содержание продукта CeO 2 может достигать 98–99%. Если pH водного раствора увеличить до 5–6, содержание CeO 2 составит всего около 95%. Если pH водного раствора устанавливается равным 1, Ce 4 + не гидролизуется полностью. Если в водном растворе остается 5% церия, содержание Ce (OH) 4 , полученного гидролизом, составляет 99% –99.9%. Процесс повторяется снова для работы с Ce (OH) 4 , и содержание Ce (OH) 4 может быть увеличено до 99,90–99,99%.
Если сырье для смешанных редкоземельных элементов представляет собой водный раствор хлоридов редкоземельных элементов, рабочие условия в основном такие же, как и для водного раствора нитрата редкоземельных элементов, но перманганат калия не добавляется отдельно. В противном случае будет израсходовано много перманганата калия на окисление Cl — с образованием хлора.Смешанный раствор KMnO 4 и Na 2 CO 3 или NH 4 HCO 3 с молекулярной пропорцией 1: 4 или 1: 8 добавляют в водный раствор смешанных редкоземельных элементов; pH водного раствора регулируется на уровне 4 для гидролиза Ce 4 + с получением Ce (OH) 4 . Реакция выглядит следующим образом:
(7,8) 3CeCl3 + KMnO4 + 8Nh5HCO3 + 2h3O = 3CeOh5 ↓ + MnO2 ↓ + 8Nh5Cl + KCl + 8CO2 ↑
Продукт Ce (OH) 4 , полученный из водного раствора перманганата калия. хлорида редкоземельного элемента серо-желтого цвета и содержит много MnO 2 , которое необходимо удалить.MnO 2 в Ce (OH) 4 можно удалить, используя соляную кислоту для растворения осадка, а щавелевую кислоту используют для осаждения редкоземельных элементов. Но хлор, вредный для операторов и окружающей среды, выделяется при растворении Ce (OH) 4 HCl. Теперь процесс был улучшен путем приготовления суспензии Ce (OH) 4 с водой, а затем в суспензию добавляется твердая щавелевая кислота для восстановления Ce (OH) 4 до Ce 2 (C 2 О 4 ) 3 ; реакции следующие:
Но хлор, вредный для операторов и окружающей среды, выделяется при растворении Ce (OH) 4 HCl. Теперь процесс был улучшен путем приготовления суспензии Ce (OH) 4 с водой, а затем в суспензию добавляется твердая щавелевая кислота для восстановления Ce (OH) 4 до Ce 2 (C 2 О 4 ) 3 ; реакции следующие:
(7.9) 2CeOh5 + 4h3C2O4 = Ce2C2O43 ↓ + 8h3O + 2CO2 ↑
(7.10) MnO2 + h3C2O4 + 2HCl = MnCl2 + 2h3O + 2CO2 ↑
MnO 2 одновременно восстанавливается до MnO 2 раствор для разделения Mn и церия. Этот метод может снизить потребление HCl и избежать выделения хлора в процессе. Но при промышленной эксплуатации MnO 2 трудно удалить полностью, а содержание MnO 2 в продукте CeO 2 составляет более 0,15%.
В процессе разделения церия с использованием перманганата калия, помимо гидролиза, который осаждает Ce (OH) 4 , азотная и серная кислоты могут использоваться для растворения оксидов редкоземельных элементов; перманганат калия используется для окисления Ce 3 + в Ce 4 + в высокой кислотности; а затем органический фосфорный экстрагент, такой как ТБФ или Р 204 , применяется для выделения Се 4 + с целью выделения СеО 2 из 99 высокой чистоты.99%.
и перманганат LIQUOX®: CARUSOL® C: Информация о холодной погоде: CARUSOL®: Новости водного рынка: Carus Group
В зимние месяцы во многих регионах США, Канады и Европы наблюдаются продолжительные периоды холодных дней и ночей. Продукты CARUSOL ® жидкий перманганат, CARUSOL ® C жидкий перманганат и LIQUOX ® перманганат натрия могут подвергаться воздействию низких температур во время транспортировки и хранения.
Продукты CARUSOL, CARUSOL C и LIQUOX представляют собой водные растворы и могут замерзать при воздействии холода в течение многих часов. Эти продукты устойчивы к замораживанию / оттаиванию, и их растворимость восстанавливается при нагревании.
Эти продукты устойчивы к замораживанию / оттаиванию, и их растворимость восстанавливается при нагревании.
Команда по производству перманганатов напоминает вам, что эти продукты содержат небольшое количество остаточных ионов калия. При воздействии низких температур могут образовываться небольшие кристаллы перманганата калия (KMnO 4 ).Эти кристаллы могут выпадать в осадок из раствора и оседать на дно упаковок и контейнеров для хранения из-за снижения растворимости перманганата калия при более низких температурах.
Пурпурные игольчатые кристаллы KMnO 4 могут появляться на дне контейнеров, бочек или ведер при транспортировке или хранении при температурах ниже 13 ºC или 55 ºF. На приведенном ниже графике показана растворимость KMnO 4 в 40% перманганате натрия в зависимости от температуры.
Во избежание кристаллизации транспортировочные контейнеры CARUSOL, CARUSOL C и LIQUOX следует хранить в теплом помещении. Если резервуары для хранения наливных и полунавальных емкостей, дозирующие насосы и питающие линии расположены снаружи, они должны иметь обогрев и изоляцию.
Один из способов ограничить возможное наличие кристаллов перманганата на дне контейнеров или бочек — это кратковременно перемешать содержимое контейнеров или бочек перед переносом в смесительные баки, чтобы кристаллы перманганата снова растворились.
Если перманганат натрия уже был перенесен в резервуар для смешивания и на дне резервуара есть кристаллы, добавьте воду в контейнер, чтобы помочь солюбилизировать кристаллы обратно в раствор.
КАРУСОЛ ® Жидкий перманганат, КАРУСОЛ ® C Жидкий перманганат , и LIQUOX ® 30
ВНИМАНИЕ: Воздействие температур <38 o F (3 o C) может вызвать образование кристаллов перманганата калия. При 21 o F (-6 o C) CARUSOL ® Жидкий перманганат может замерзнуть. При температуре 5 o F (-15 o C) CARUSOL ® C Жидкий перманганат может замерзнуть. CARUSOL ® , CARUSOL ® C и LIQUOX ® замороженные / замороженные таханаты. |
СПЕЦИАЛЬНЫЕ УКАЗАНИЯ
Эта информация была собрана с помощью анализов контроля качества и отчетов полевых данных и предназначена в качестве физико-химического руководства для использования нашими клиентами. Насколько нам известно, он актуален и точен. Если у вас есть дополнительные вопросы или комментарии, свяжитесь с нами.
Версия для печати PDF
Удаление перманганата калия из воды · Waterlogic
Перманганат калия — это химический раствор, который регулярно используется для лечения и удаления бактерий, растворенных минералов железа, токсичных соединений, марганца, запаха хлора, а также сероводорода, который может вызвать повреждение крана. вода пахнет как тухлые яйца.При использовании в больших количествах вода из-под крана может стать ярко-розовой или даже темно-фиолетовой.
Добавление перманганата калия является одним из первых шагов, выполняемых в процессе обработки, и в конечном итоге удаляется путем фильтрации и дезинфекции. Нерегулярное количество или механические неисправности могут привести к выделению избыточного количества во время лечения, делая вашу воду ярко-розовой, а иногда и темно-фиолетовой. Несмотря на то, что водные системы работают над удалением перманганата путем промывки распределительной системы, розовая вода все равно может достигать вашего крана.
Если вы обнаружите перманганат калия в водопроводной воде, выполните следующие действия, чтобы быстро исправить ситуацию:
- Подайте холодную воду из-под крана как можно ближе к основному источнику — обычно это на кухне.
- Включите другие краны в вашем доме — они тоже розовые?
- Как ваши соседи — проблема не может быть изолирована от вашего места жительства и может затрагивать окружающие дома.
- Обратитесь к сертифицированному водопроводчику или поставщику воды для дальнейшего изучения проблемы. Следите за дополнительной информацией и советами на веб-сайте поставщика воды и в социальных сетях.
Хотя любые пятна, оставленные разбавленным перманганатом калия, не сохраняются надолго, это химическое вещество может вызвать раздражение чувствительной кожи. Если вы вступили в контакт с разбавленной формой граната калия, немедленно промойте открытые участки кожи в течение как минимум пятнадцати минут.
Любое воздействие концентрированной формы перманганата калия может вызвать раздражение кожи, и вам необходимо обратиться к врачу или в отделение неотложной помощи, если вы почувствуете какие-либо ожоги, боль, отек или покраснение кожи.
Окисление алкенов манганатом калия
Двойные углерод-углеродные связи в алкенах, таких как этен, реагируют с раствором манганата калия (VII) (раствор перманганата калия).
Окисление алкенов холодным разбавленным раствором манганата (VII) калия
Алкены реагируют с раствором манганата (VII) калия на холоде. Изменение цвета зависит от того, используется ли манганат калия (VII) в кислых или щелочных условиях.
- Если раствор манганата калия (VII) подкисить разбавленной серной кислотой, пурпурный раствор станет бесцветным.
- Если сделать раствор манганата калия (VII) слабощелочным (часто путем добавления раствора карбоната натрия), пурпурный раствор сначала становится темно-зеленым, а затем образует темно-коричневый осадок.

Химия реакции
Посмотрим на реакцию с этеном. Точно так же реагируют и другие алкены. Ионы манганата (VII) являются сильным окислителем и в первую очередь окисляют этен до этан-1,2-диола (старое название: этиленгликоль). Рассмотрим уравнение исключительно с точки зрения органической реакции:
Уравнения этого типа довольно часто используются в органической химии. Кислород, записанный в квадратных скобках, означает «кислород окислителя».Причина этого в том, что более нормальное уравнение имеет тенденцию скрывать органические изменения массой других деталей — как вы увидите ниже!
Полное уравнение зависит от условий.
- В кислых условиях ионы манганата (VII) восстанавливаются до ионов марганца (II).
- В щелочных условиях ионы манганата (VII) сначала восстанавливаются до зеленых ионов манганата (VI). . .
. . . а затем до темно-коричневого твердого оксида марганца (IV) (диоксида марганца).
Эту последнюю реакцию вы также получили бы, если бы реакцию проводили в нейтральных условиях. Вы заметите, что в левой части уравнения нет ни ионов водорода, ни ионов гидроксида.
Возможно, вы помните, что дальше на странице говорится, что манганат калия (VII) часто слегка подщелачивают, добавляя раствор карбоната натрия. Где в этом гидроксид-ионы? Карбонат-ионы до некоторой степени реагируют с водой с образованием ионов гидрокарбоната и гидроксид-ионов.- \]
Именно присутствие этих гидроксид-ионов придает раствору карбоната натрия pH в диапазоне 10-11.
Использование реакции для проверки двойных связей углерод-углерод
Если органическое соединение реагирует с разбавленным щелочным раствором манганата калия (VII) на холоде с образованием зеленого раствора с последующим темно-коричневым осадком, то оно может содержать двойную связь углерод-углерод. Но в равной степени это может быть любое из большого количества других соединений, все из которых могут окисляться ионами манганата (VII) в щелочных условиях.
Ситуация с подкисленным раствором манганата (VII) калия еще хуже, потому что он имеет тенденцию к разрыву углерод-углеродных связей. Он разрушительно реагирует с большим количеством органических соединений и редко используется в органической химии.
Вы могли бы использовать щелочной раствор манганата калия (VII), если, например, все, что вам нужно было сделать, это выяснить, является ли углеводород алканом или алкеном — другими словами, если нет ничего другого, что можно было бы окислить.Это бесполезный тест. Бромная вода гораздо более понятна.
Окисление алкенов горячим концентрированным подкисленным раствором манганата (VII) калия
Диолы, такие как этан-1,2-диол, которые являются продуктами реакции с холодным разбавленным манганатом калия (VII), сами довольно легко окисляются ионами манганата (VII). Это означает, что реакция не будет удерживать p в этот момент, если раствор манганата калия (VII) не будет очень разбавленным, очень холодным и предпочтительно не в кислых условиях.Если вы используете горячий концентрированный раствор подкисленного манганата калия (VII), то, что вы в конечном итоге получите, зависит от расположения групп вокруг двойной углерод-углеродной связи.
Приведенная ниже формула представляет собой общий алкен. В органической химии символ R используется для обозначения углеводородных групп или водорода в формуле, когда вы не хотите говорить о конкретных соединениях. Если вы используете символ более одного раза в формуле (как здесь), различные группы записываются как R 1 , R 2 и т. Д.
В этом конкретном случае двойная связь окружена четырьмя такими группами, и они могут быть любой комбинацией одинаковых или разных — так что они могут быть 2 атомами водорода, метилом и этилом, или 1 атомом водорода и 3 метилами, или 1 атомом водорода. и 1 метил, 1 этил и 1 пропил, или любую другую комбинацию, о которой вы можете подумать. Другими словами, эта формула представляет все возможные простые алкены:
Первая ступень расширенного окисления
Подкисленный раствор манганата калия (VII) окисляет алкен, разрывая двойную связь углерод-углерод и заменяя ее двумя двойными связями углерод-кислород.
Эти продукты известны как карбонильные соединения , потому что они содержат карбонильную группу C = O. Карбонильные соединения также могут реагировать с манганатом калия (VII), но то, как они реагируют, зависит от того, что присоединено к двойной связи углерод-кислород. Поэтому нам нужно проработать все возможные комбинации.
Если обе присоединенные группы R в продуктах являются алкильными группами
Карбонильные соединения, которые имеют две углеводородные группы, присоединенные к карбонильной группе, называются кетонами.Кетоны не так просто окислить, поэтому дальнейших действий нет. (Но см. Примечание, выделенное красным ниже.) Если бы группы, присоединенные по обе стороны от исходной двойной углерод-углеродной связи, были одинаковыми, то в итоге вы получили бы единственный кетон. Если бы они были разными, вы бы получили смесь двух. Например:
В этом случае вы получите две идентичные молекулы, называемые пропаноном. С другой стороны, если одна из метильных групп в исходной молекуле была заменена этильной группой, вы получили бы смесь двух разных кетонов — пропанона и бутанона.
Что бы вы получили, если бы по обе стороны от исходной двойной связи углерод-углерод были метильная и этильная группы? Опять же, вы получите единственный кетон — в данном случае бутанон. Если вы не уверены в этом, нарисуйте конструкции и посмотрите.
Этот последний раздел является чрезмерным упрощением. На практике в этих условиях кетоны окисляются раствором манганата (VII) калия. Реакция протекает неаккуратно и приводит к разрыву углерод-углеродных связей по обе стороны от карбонильной группы.Манганат калия (VII) — настолько разрушительный окислитель, что его редко используют в органической химии.
Если продукт содержит одну углеводородную группу и один водород
Например, предположим, что первая стадия реакции была:
В этом случае первая молекула продукта имеет метильную группу и водород, присоединенный к карбонильной группе. Это другой вид соединения, известный как альдегид. Альдегиды легко окисляются с образованием карбоновых кислот, содержащих группу -COOH.Таким образом, на этот раз реакция пойдет на следующую стадию с получением этановой кислоты, CH 3 COOH.
Кислотная структура была немного изменена, чтобы она больше походила на то, как мы обычно извлекаем кислоты, но в конечном итоге кислород оказался между углеродом и водородом. Таким образом, общий эффект манганата калия (VII) на этот вид алкена составляет:
Очевидно, если бы к обоим атомам углерода на концах двойной углерод-углеродной связи был присоединен атом водорода, вы бы получили две молекулы карбоновой кислоты, которые могли бы быть одинаковыми или разными, в зависимости от того, были ли одинаковые алкильные группы. или другое.
Поиграйте с этим, пока не будете довольны. Изобразите несколько алкенов, каждый из которых имеет водород, присоединенный к обоим концам двойной углерод-углеродной связи. Меняйте алкильные группы — иногда одинаковые на каждом конце двойной связи, иногда разные. окислите их, чтобы образовались кислоты, и посмотрите, что у вас получится.
Если в продукте есть два атома водорода, но нет углеводородной группы
Вы, возможно, ожидали, что это приведет к образованию метановой кислоты, как в уравнении:
Но это не так! Это потому, что метановая кислота также легко окисляется раствором манганата калия (VII).Фактически, он полностью окисляет его до углекислого газа и воды. Таким образом, уравнение в таком случае может быть, например:
Точная природа другого продукта (в этом примере пропанона) будет варьироваться в зависимости от того, что было присоединено к правому атому углерода в двойной связи углерод-углерод. Если бы на обоих концах двойной связи было два атома водорода (другими словами, если бы у вас был этен), то все, что вы получили бы, — это углекислый газ и вода.
Пример
Работа с результатами поможет вам определить структуру алкена.Например, алкен C 4 H 8 имеет три структурных изомера:
Определите, какие из них дали бы каждый из следующих результатов, если бы их обрабатывали горячим концентрированным раствором манганата (VII) калия.
- Изомер A дает кетон (пропанон) и диоксид углерода.
- Изомер B дает карбоновую кислоту (пропановую кислоту) и диоксид углерода.
- Изомер C дает карбоновую кислоту (этановую кислоту).
РЕШЕНИЕ
Кислоты образуются, когда атом водорода присоединен по крайней мере к одному из атомов углерода в двойной связи углерод-углерод.Поскольку в C есть только один продукт, алкен должен быть симметричным относительно двойной связи. Это бут-2-ен. Если у вас есть два атома водорода на одном конце связи, это приведет к образованию углекислого газа. А — это 2-метилпропен, потому что другая молекула — кетон. B должен быть бут-1-еном, потому что он производит углекислый газ и кислоту.
.
 Возможно засорение всасывающих линий малого диаметра на насосах-дозаторах, фильтрах для твердых частиц и обратных клапанах.
Возможно засорение всасывающих линий малого диаметра на насосах-дозаторах, фильтрах для твердых частиц и обратных клапанах.