Питание (диета) при дисбактериозе кишечника
Дисбактериоз кишечника проявляется в тот или иной момент у большинства взрослых людей и практически у всех детей. Причин, вызывающих это состояние может быть множество и, конечно, уберечь себя от всех причин развития дисбактериоза просто невозможно. На состоянии кишечной микрофлоры может отразиться и экология, и хронический стресс, и различные заболевания и даже эмоциональное состояние. Однако здоровье человека, и особенно состояние пищеварительной системы, во многом зависит от того, что он ест. Лучшим способом профилактики дисбактериоза является полноценное, сбалансированное питание.
Но что делать, если дисбактериоз уже развился? Как восстановить баланс микрофлоры? Лечение дисбактериоза должно быть комплексным и рекомендованным гастроэнтерологом индивидуально в каждом случае. Однако можно и самостоятельно помочь своему организму, изменив стиль питания. Питание при дисбактериозе кишечника не должно содержать продуктов, раздражающих слизистую оболочку желудка и кишечника или способствующих процессам гниения и гиперсекреции желчи и желудочного сока.
Диета при дисбактериозе кишечника предполагает ограничение употребления острых и соленых блюд, специй и маринадов. Из рациона следует исключить кондитерские изделия, содержащие большое количество сахара, т.к. они усиливают нежелательные процессы брожения в кишечнике. Поэтому от конфет, шоколада, пирожных и тортов придется отказаться. Хлеб и сдобу лучше заменить сухариками. О любых консервированных продуктах, соленых и маринованных заготовках, тоже лучше забыть на время лечения от дисбактериоза. Также не стоит нагружать желудок и кишечник жирным мясом и рыбой, грибами, колбасами, копчениями и бобовыми. Оптимально диета при дисбактериозе кишечника должна состоять из нежирных продуктов, приготовленных на пару с ограниченным применением специй. Полезно готовить супы и каши (кроме перловой и пшеной).
Что касается напитков, то диета при дисбактериозе кишечника не должна включать кофе с молоком, и конечно, алкоголь. Особенно вредны при этом заболевании слабоалкогольные напитки, такие как пиво и вино, способные вызвать обострение. Лучше всего в период лечения пить несладкие компоты, воду и чай. Кроме того, стоит помнить, что напитки разжижают желудочный сок, что затрудняет процессы переваривания. Поэтому старайтесь пить как минимум за двадцать минут до еды и через час после, а не вовремя приема пищи.
Особенно вредны при этом заболевании слабоалкогольные напитки, такие как пиво и вино, способные вызвать обострение. Лучше всего в период лечения пить несладкие компоты, воду и чай. Кроме того, стоит помнить, что напитки разжижают желудочный сок, что затрудняет процессы переваривания. Поэтому старайтесь пить как минимум за двадцать минут до еды и через час после, а не вовремя приема пищи.
Ещё статьи:
Возникновение дисбактериоза после антибиотиков. Бифилакт БИОТА
Другие статьи из рубрики «Болезни пищеварительной системы»:
Дисбактериоз: понятие, виды, тактика лечения. Бифилакт БИОТА
Хронический дисбактериоз кишечника, признаки и симптомы. Бифилакт БИОТА
Хронический дисбактериоз, от чего возникает, симптомы и причины. Бифилакт биота
Диета во время дисбактериоза, продукты для взрослых и детей. Бифилакт БИОТА
Повышение температуры во время дисбактериоза. Бифилакт БИОТА
Сыпь при дисбактериозе: причины и симптомы у детей и взрослых. Бифилакт БИОТА
Бифилакт БИОТА
Основные причины развития дисбактериоза. Бифилакт БИОТА
Перечень лекарств от дисбактериоза. Бифилакт БИОТА
Возникновение дисбактериоза после антибиотиков. Бифилакт БИОТА
Диета при дисбактериозе. Бифилакт БИОТА
Какой врач лечит дисбактериоз кишечника: симптомы, причины заболевания. Бифилакт БИОТА
Грибковое поражение пищеварительной системы
Запор и его лечение, причины, профилактика. Бифилакт БИОТА
Средства от запора. Таблетки, прибиотики, слабительные. Бифилакт БИОТА
Эффективные домашние средства от запора. Бифилакт БИОТА
Что есть во время запора. Бифилакт БИОТА
Запор у пожилых, основные причины, терапия. Бифилакт БИОТА
Запор у взрослого человека, причины возникновения и лечение. Бифилакт БИОТА
Что делать при возникновении запора. Несколько действенных советов. Бифилакт БИОТА
Как в домашних условиях делать клизму, во время запора. Бифилакт БИОТА
Лактазная недостаточность. Бифилакт БИОТА
Вздутие кишечника: лечение вздутия кишечника. Бифилакт БИОТА
Причины вздутия живота и появления запора. Бифилакт БИОТА
Бифилакт БИОТА для лечения печени
Бифилакт БИОТА для лечения желудка
Синдром раздраженного кишечника. Бифилакт БИОТА
Колит: симптомы и лечение. Бифилакт БИОТА
Энтероколит: симптомы и лечение энттороколита. Бифилакт БИОТА
Бифилакт БИОТА для лечения кишечника
Организм человека подвергается воздействию антибиотиков не только при приеме антибиотиков в случае каких-то заболеваний у конкретного индивидуума, но и при поедании продуктов ( мясо животных или растений), подвергшихся воздействию антибиотиков. При бесконтрольном применении антибиотиков могут возникать негативные последствия для здоровья, например, в кишечнике, после гибели от антибиотиков полезных бактерий, могут отбираться и приобретать преимущества ранее подавленные патогены, которые могут , в свою очередь, вызывать острые заболевания. Изменение микрофлоры под воздействием антибиотиков может влиять и на развитие хронических заболеваний в перспективе, т.к. под воздействием антибиотиков происходят мутации (изменения) в генах бактерий, которые приводят к изменению их влияния на многие физиологические процессы в организме человека, на регуляцию иммунного ответа и обменные процессы ( метаболического гомеостаза). Кроме того, воздействие антибиотиков может приводить к развитию устойчивости бактерий к антибиотикотерапии. Такие устойчивые бактерии быстро распространяются в популяции людей и передают устойчивость к антибиотикам другим видам бактерий. Это создает трудности для борьбы с разнообразными бактериальными инфекциями у людей. Антибиотики не помогают. Приходится ученым искать все новые и новые антибиотики и способы борьбы с патогенными бактериями и теми болезнями, которые они вызывают. Ученые и медики обеспокоены такими темпами нарастания устойчивости микрофлоры к антибиотикам и обращаются с призывами прекратить бесконтрольное применение антибиотиков.
Изменение микрофлоры под воздействием антибиотиков может влиять и на развитие хронических заболеваний в перспективе, т.к. под воздействием антибиотиков происходят мутации (изменения) в генах бактерий, которые приводят к изменению их влияния на многие физиологические процессы в организме человека, на регуляцию иммунного ответа и обменные процессы ( метаболического гомеостаза). Кроме того, воздействие антибиотиков может приводить к развитию устойчивости бактерий к антибиотикотерапии. Такие устойчивые бактерии быстро распространяются в популяции людей и передают устойчивость к антибиотикам другим видам бактерий. Это создает трудности для борьбы с разнообразными бактериальными инфекциями у людей. Антибиотики не помогают. Приходится ученым искать все новые и новые антибиотики и способы борьбы с патогенными бактериями и теми болезнями, которые они вызывают. Ученые и медики обеспокоены такими темпами нарастания устойчивости микрофлоры к антибиотикам и обращаются с призывами прекратить бесконтрольное применение антибиотиков.
Дисбактериоз после антибиотиков: как появляется патология
Если антибиотики назначаются в несоответствии с дозировкой, самостоятельно, используются некачественные или простроченные препараты, а также, если лечение продлевается без необходимости – все это ухудшает состав микрофлоры, развивая устойчивость к антибиотикам.
В зависимости от применяемых антибактериальных препаратов, как у взрослых, так и у детей, проявляются различные патологические изменения:
Аминопенициллины – после неконтролируемого и длительного использования происходит рост стафилококков и стрептококков;
Тетрациклины – после попадания внутрь, препараты негативно влияют на слизистую поверхность кишечника, нарушая ее, что приводит к увеличению роста вредных микроорганизмов, в частности клостидий, кандиды и стафилококков.

Фунгициды – под действием данных препаратов происходит размножение эшерихий и протейных бактерий.
Аминогликозиды – негативно сказываются на росте полезных бактерий.
Антибиотики вызывают такие мутации (изменения) генов у бактерий в кишечнике, которые приводят к тому, что ранее условно-патогенная бактерия становится патогенной и начинает проявлять свои агрессивные свойства, что приводит к острому проявлению заболевания. В частности часто встречаются диареи, связанные с приемом антибиотиков. Так, например, такие микроорганизмы, как Klebsiellapneumoniae(Клебсиелла пневмония) , Staphylococcusaureus(Золотистый стафилококк), Clostridiumdifficile (Клостридиядифициле) могут начать проявлять свою патогенность, что может вызывать у человека, трудноизлечимые, длительные рецидивирующие инфекции и даже потенциально смертельный псевдомембранозный колит. Защитную роль от этих состояний обнаруживают бифидумбактерии. Важно поддерживать их количество в кишечнике, чтобы избежать осложнений.
Кроме того, одним из опасных осложнений антибиотикотерапии у людей с ослабленным иммунитетом является сепсис, когда патогенные бактерии прорываются из кишечника в кровь. Так, было показано, что изменение генов (мутации) у энтерококков и появление у них устойчивости к ванкомицину способствует попаданию его в кровь и сепсису.
У недоношенных детей, которых лечили антибиотиками широкого спектра действия, часто развивался сепсис.
Помимо инфекционных осложнений неконтролируемый и длительный прием антибиотиков может приводить к нарушению иммунного гомеостаза. Так, атопический дерматит, воспалительные и аутоиммунные заболевания, астма являются проявлением дисбактериоза кишечника. Выявлена связь между применением антибиотиков у детей в раннем возрасте,у беременных и развитием этих заболеваний у детей впоследствии. Стало очевидно, что последствия дисбактериоза, вызванного антибиотикотерапией, более выражены, если они появляются в раннем детстве, когда иммунная система ребенка только формируется.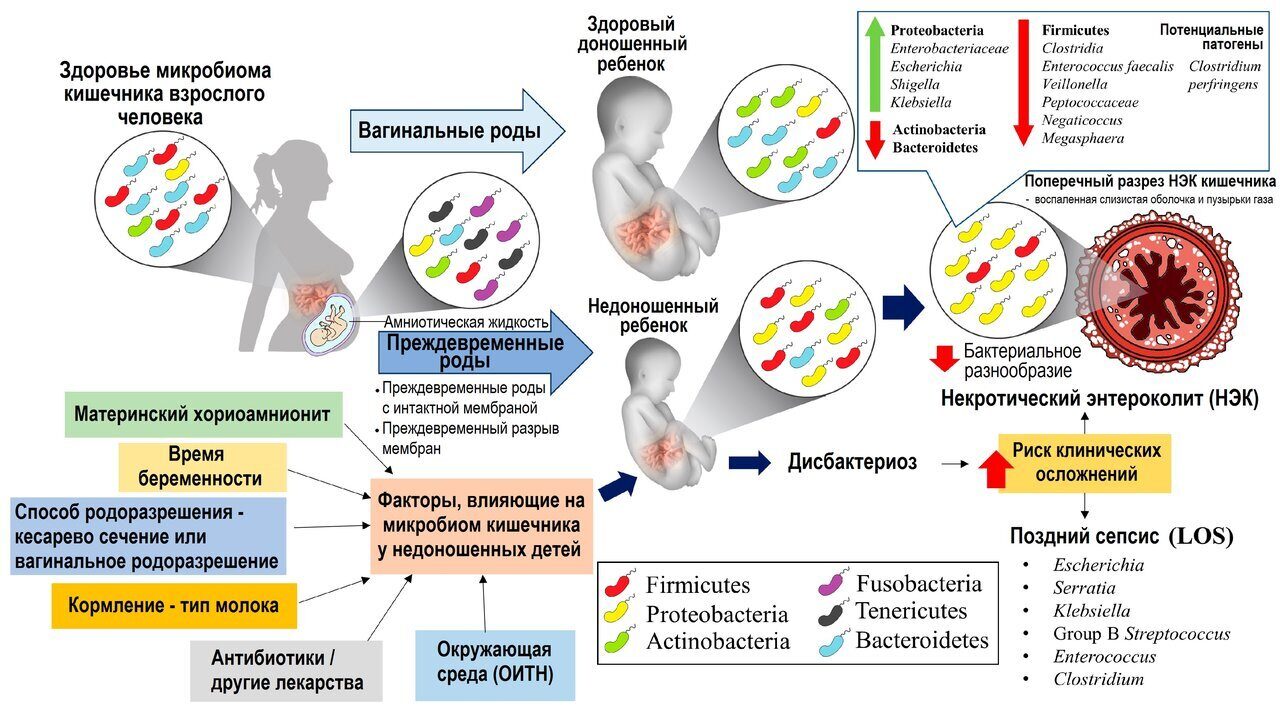
Синдром раздраженного кишечника, также является частым осложнение дисбактериоза после антибиотикотерапии.
Ожирение является результатом нарушения метаболизма человека и его связывают с дисбактериозом. Это согласуется с тем, что применение антибиотиков используется для повышения веса у сельскохозяйственных животных. Кроме этого, у людей с ожирением применение антибиотиков может приводить к развитию метаболического синдрома, который представляет из себя группу метаболических состояний, которые повышают риск развития сердечно-сосудистых заболеваний, жировой болезни печени (жировой гепатоз), стеатогепатита и диабета 2-го типа.
Выявлена связь с применением антибиотиков и развитием инсулинозависимого диабета 1-го типа. Повторное употребление пенициллина, цефалоспоринов, макролидов и хинолонов приводит к увеличению риска развития диабета 1-го типа. И в этом случае доказана связь с изменением микрофлоры кишечника после антибиотикотерапии.
И в этом случае доказана связь с изменением микрофлоры кишечника после антибиотикотерапии.
Применение антибиотиков негативно влияют на способность организма боротся с инфекциями. Они уменьшают способность бифидумбактерий и лактобактерий и других грамположительных микроорганизмов в кишечнике выделять антибиотикоподобные вещества, чтобы бороться с инфекциями.
Антибиотики, уничтожая полезные бактерии, способствуют возникновению истончения слизистой кишечника и хроническому воспалительному процессу в кишечнике.
При антибиотикотерапии снижается количество бифидумбактерий и лактобактерий, которые производят в кишечнике короткоцепочечные жирные кислоты: ацетат, пропионат, бутират. Эти соединения являются основными факторами поддержания целостности кишечной стенки, повышают иммунологический и метаболический (обменный) гомеостаз (постоянство) и имеют важные противовоспалительные и противоопухолевые свойства. Их отсутствие при дисбактериозе приводит к целому ряду тяжелых заболеваний, в том числе, к онкологии.
Развитию дисбиоза подвержены люди в любом возрасте, даже если антибиотик подобран с учетом особенностей заболевания, возраста, результатов диагностики и соблюдения необходимой дозировки. Своевременное обнаружение нарушения содержания бифидумбактерий и лактобактерий в кишечнике, и выявление патогенной микрофлоры,позволит подобрать правильные методы восстановления количества полезной микрофлоры и профилактики дисбактериоза. Для этого используются пробиотические препараты. Эффективно восстанавливают нормальное количество полезныхбактрий в кишечнике препараты с живыми бифидумбактериями и лактобактериями. Такие бактерии имеют способность приживаться в кишечнике и оставаться в нем. Сухие препараты бактерий, лишенные жизнедеятельности, помогают только временно и выводятся из кишечника после окончания приема. В этой связи очень важно применять во время антибиотикотерапии и после нее кисломолочный пробиотический лечебно-профилактический продукт бифилакт БИОТА с живыми и активными бифидумбактериями ,лактобактериями и лечебными продуктами их жизнедеятельности: кислотами, ферментами, витаминами, микроэлементами, антибактериальными веществами, аминокислотами (ПРЕИМУЩЕСТВА БИФИЛАКТА БИОТА). Биота быстро и эффективно восстанавливает микрофлору кишечника и все ее полезные свойства для организма человека (ЛЕЧЕБНЫЕ СВОЙСТВА БИФИЛАКТА БИОТА). Эффективность бифилакта БИОТА для лечения и профилактики дисбактериоза доказана клинически в детских и взрослых лечебно-профилактических учреждениях. Бифилакт БИОТА награжден 9 Золотыми медалями за качество и функциональность. Достаточно принимать по 1-2 стакана бифилакта БИОТА в день за 20-30 минут до еды или через 40 минут после еды во время антибиотикотерапии и в течение 1,5 – 2 месяцев после окончания применения антибиотиков, чтобы профилактировать дисбактериоз.
Биота быстро и эффективно восстанавливает микрофлору кишечника и все ее полезные свойства для организма человека (ЛЕЧЕБНЫЕ СВОЙСТВА БИФИЛАКТА БИОТА). Эффективность бифилакта БИОТА для лечения и профилактики дисбактериоза доказана клинически в детских и взрослых лечебно-профилактических учреждениях. Бифилакт БИОТА награжден 9 Золотыми медалями за качество и функциональность. Достаточно принимать по 1-2 стакана бифилакта БИОТА в день за 20-30 минут до еды или через 40 минут после еды во время антибиотикотерапии и в течение 1,5 – 2 месяцев после окончания применения антибиотиков, чтобы профилактировать дисбактериоз.
Всегда ли возникает дисбактериоз после приема антибиотиков
Антибактериальная терапия назначается при многих патологических процессах и инфекционных заболеваниях, подбор препаратов должен проводить только лечащий врач на основании диагностики. Но даже самый точный поход и соблюдений всех рекомендаций, в том числе дозировки препарата не может дать гарантию того, что через некоторое время не появиться дисбактериоз.
Также некоторые пациенты самостоятельно продлевают лечения или проводят антибактериальную профилактику, что категорически нельзя. Поэтому можно сделать вывод, что при любых обстоятельствах избежать нарушения микрофлоры не удастся, разница лишь в тяжести течения и проявления симптоматики.
Необходимо учесть, что данная патология может появиться даже у детей, находящихся на грудном вскармливании, если во время беременности женщина принимала антибактериальные препараты.
Симптомы дисбактериоза
После приема антибактериальных препаратов, дисбактериоз может развиться не только в кишечнике, но и половых органах, по-другому называется кандидоз или молочница. При таком течении больной испытывает дискомфорт в интимной зоне, появляются творожистые выделения и кислый неприятный запах. Такое состояние требует обязательного лечения, поскольку кандидоз может привести к развитию осложнений, в том числе сказаться на репродуктивной системе. Очень часто, вагинальный дисбактериоз ( ДИСБАКТЕРИОЗ В ГИНЕКОЛОГИИ: ДИСБАКТЕРИОЗ ВЛАГАЛИЩА – ВАГИНИТ) сопровождается сильным зудом влагалища и половых органов. При несвоевременном лечении и присоединении других патологий появляется боль внизу живота, что может указывать на воспалительный процесс.
При несвоевременном лечении и присоединении других патологий появляется боль внизу живота, что может указывать на воспалительный процесс.
При дисбактериозе кишечника у больного появляется тошнота, изжога, вздутие живота, нарушается стул. Симптомы дисбактериоза могут появиться как через сутки после начала приема антибиотиков, так и по окончанию лечения. Нередко можно встретить сочетание вагинальногои кишечного дисбактериоза.
Сразу после появления симптоматики необходимо проконсультироваться с врачом.
Признаки дисбактериоза
Признаки дисбактериоза зависят от тяжести патологического процесса, происходящего в кишечнике. Нарушение микрофлоры проявляется в следующих признаках:
появление болей в животе;
нарушение стула, смена диареи запорами;
дискомфорт в области живота;
тошнота;
потеря аппетита;
вздутие, повышенное газообразование;
изменение цвета фекалий;
иногда боль в голове;
раздражение в заднем проходе.

В детском возрасте, помимо данной симптоматики,дисбиоз сопровождается режущими болями в животе, которые проходят после опорожнения кишечника. Также ребенка может мучить тошнота, слабость и беспокойный сон.
Если антибактериальная терапия была проведена правильно, с выполнением всех рекомендаций врача, то симптомы присутствуют частично и имеют вялотекущий характер. Если же антибиотики были использованы самостоятельно либо без учета дозировки, то у больного отмечается совокупность признаков, что значительно ухудшает качество жизни. Дисбактериоз II-IV стадии обязательно нужно лечить ( ДИСБАКТЕРИОЗ И ПОЧЕМУ ЕГО НАДО ЛЕЧИТЬ)
Терапия дисбактериоза
Лечебные мероприятия по восстановлению состава микрофлоры могут потребовать продолжительного времени. Для того чтобы терапия была эффективной , необходимо обратиться к специалисту, который после ряда обследований и на основании жалоб больного сможет подобрать максимально эффективное средство от дисбактериоза.
При любом течении заболевания лечение включает в себя следующие пункты:
прием лекарственных препаратов, помогающих нормализовать микрофлору кишечника и восстановить баланс между полезными и патогенными микроорганизмами;
включение в терапию бактериофагов, которые помогают подавить рост и численность вредных бактерий, предназначенных для лечения 1 и 2 степени дисбиоза;
соблюдение правил питания, которое заключается в исключении группы продуктов, способствующих размножению вредных бактерий и включениепробиотических продуктов, богатых живыми полезными микроорганизмами
От того, насколько будет правильно и эффективно проведено лечение зависит дальнейшее состояние здоровье кишечника. Поскольку флора кишечника очень чувствительна к внешним раздражителям, то очень важно соблюдать все рекомендации по комплексному лечению и методам профилактики, что поможет снизить до минимума риск развития дисбиоза в будущем.
Терапия дисбиоза основывается не только на тяжести течения болезни, но и причинах развития. Эффективность и исход лечения может быть только при условии комплексного подхода, который состоит из следующих восстановительных мероприятий:
восстановление уровня бактерий;
восстановление опорожнения кишечника;
восстановление иммунной защиты;
возобновление транспортировки питательных веществ, получаемых из пищи в межклеточное пространство, кровь и лимфатическую систему.
Лекарственные препараты позволяютвосстановить микрофлору кишечника, устранить неприятную симптоматику болезни, а также скорректировать иммунитет.
Наиболее эффективно восстанавливает бифидумбактерии и лактобактерии в кишечнике кисломолочный пробиотический продукт лечебно-профилактического питания бифилакт БИОТА, в котором эти бактерии находятся в живом состоянии, что позволяет им адгезироваться (прикрепляться) не стенки кишечника и эффективно размножаться ( БИФИЛАКТ БИОТА ДЛЯ ЛЕЧЕНИЯ ДИСБАКТЕРИОЗА У ВЗРОСЛЫХ)
Восстановительная диета
Для того чтобы избавиться от дисбактериоза одного медикаментозного лечения недостаточно, требуется пересмотреть свое питание, исключив все продукты, которые могут ухудшить течение болезни, вызывать процессы гниения и брожения, повышенное газообразование, воспаление и боли в животе.
Весь дневной рацион следует разделить на 4 приема пищи с равными промежутками времени, данному распорядку необходимо строго придерживаться. Если дисбиоз сопровождается жидким стулом, то из рациона необходимо исключить послабляющие продукты, а именно сырые фрукты и овощи, жирное мясо и рыбу, молочные продукты, газированные напитки и сдобную выпечку, которые оказывают раздражающее воздействие на кишечник.
Если при дисбактериозе у больного нарушается опорожнение кишечника, необходимо включить в рацион растительные масла и кисломолочные продукты, исключив крепкий кофе, чай, рис, шоколад и картофель.
Во время восстановления флоры кишечника необходимо снизить до минимума потребление капусты и бобовые продукты, которые способствуют повышению газообразования. Улучшить эффективность принимаемых препаратов можно яблоками, клюквой, малиной и черникой – продуктами, обладающие антимикробными свойствами и позволяющие восполнить недостатков важных микроэлементов и витаминов, при условии отсутствия на них негативной реакции организма.
Перечень продуктов, которые необходимо включить в свой рацион:
растительное и сливочное масло;
продукты пчеловодства;
некрепкий чай, компоты и кисели;
овощи и фрукты, в тушенном или запеченном виде;
ягоды;
отварное или тушенное нежирное мясо;
вареные куриные яйца или омлет;
кисломолочные продукты – бифилакт БИОТА ( ссылка «ОПИСАНИЕ БИФИЛАКТА БИОТА)
молоко и сметану в малых количествах можно включать в готовые блюда или использовать для их приготовления;
пшено, греча, кукуруза и рис в виде каши;
овощные супы.
Продукты, которые необходимо исключить из меню:
продукты, содержащие, добавки, красители и консерванты;
восточные сладости, конфеты, шоколад;
крабовые палочки и другие имитированные рыбные продукты;
приправы;
острое, копченное;
консервы;
маринованные продукты;
сыр, сладкие йогурты, мороженое;
жирное мясо и рыба;
сосиски, колбасы, фастфуд.

Меню можно составить самостоятельно или обратиться за помощью к специалисту.
Лекарства
Восстановление баланса микроорганизмов способствуют следующие группы препаратов:
Бактериофаги – помогают уничтожить вредные микроорганизмы. Поскольку данная группа не является токсичной, их можно применять при лечении дисбиоза у новорожденных.
Пребиотики – после попадания внутрь, обволакивают верхние отделы желудочно-кишечного тракта, что создает благоприятные условия для роста полезных бактерий.
Пробиотики – помогают восстановить микрофлору кишечника, могут содержаться в продуктах (пробиотический кисломолочный продукт лечебно-профилактического питания бифилкат БИОТА), медикаментах и БАДах.
Энтеросептики – предназначены для лечения тяжелых форм дисбактериоза, после попадания внутрь уничтожает пагубные бактерии, не затрагивая полезные.
Сорбенты – для снятия интоксикации.
Препараты для иммунитета.
Ферменты для улучшения переваривания пищи.
На сегодняшний день существует большое количествопробиотических препаратов, предназначенных для лечения дисбактериоза, но к самым популярным и эффективным относятся следующие медикаменты:
Кисломолочный пробиотический продукт лечебно-профилактического питания бифилакт БИОТА с живыми бифидумбактериями, лактобактериями. Подходит для профилактики и лечения дисбактериоза у детей и взрослых. Уникальный запатентованный продукт с доказанной высокой клинической эффективностью(ссылка « НАУЧНАЯ И КЛИНИЧЕСКАЯ РАБОТА С БИФИЛАКТОМ БИОТА).
Линекс – выпускаются в капсулах, применяется одновременно с антибиотиками, не имеет побочных эффектов и противопоказаний.
Хилак Форте – выпускается в виде жидкости, разрешено одновременно использовать с антибактериальными препаратами, а также во время беременности и кормления грудью.
 Подходит для лечения дисбактериоза в любом возрасте, не имеет противопоказаний и побочных эффектов.
Подходит для лечения дисбактериоза в любом возрасте, не имеет противопоказаний и побочных эффектов.Пробифор – сироп для нормализации микрофлоры кишечника, предназначен для ежедневного применения. Совместим с другими препаратами, в том числе с антибиотиками. Разрешено использовать детям от 6 месяцев.
БифидумБактерин – выпускается в капсулах или порошке для разведения эмульсии. Использование в детском возрасте, а также в период беременности и лактации только при назначении врача. Запрещено использовать при подтверждении кандидоза, а также во время лечения антибиотиками.
БиоБактон – выпускается в виде жидкости, разрешено использовать с детского возраста. При наличии кандидоза и аллергической реакции необходимо отменить прием, противопоказано употреблять одновременно с антибактериальными лекарствами.
Ацилакт – выпускается в таблетированной форме и в виде суспензии, запрещено использовать детям младше трех лет. При применении может быть отмечено появление аллергии, разрешено к использованию при лечении антибиотиками.
 При необходимости лечения во время беременности,требуетсяконсультация врача.
При необходимости лечения во время беременности,требуетсяконсультация врача.Лактобактерин – выпускается в таблетках и порошке для разведения суспензии, не рекомендуется использовать во время лечения антибиотиками, а также при обнаружении кандидоза. При ежедневном использовании может развиться аллергия.
Также, для лечения дисбактериоза специалист может назначить ректальные свечи, разрешенные к применению детям и взрослым: Виферон, Левомецитин, Анузол, Простопин, Лактонорм, Бифинорм – позволяют не только предотвратить воспалительный процесс в кишечнике, но и снабдить его полезными бактериями.
Диета после антибиотиков: как питаться и что включить в меню? Пробиотики БАК СЕТ для восстановления организма взрослых и детей — дополнение к питанию после приема курса антибиотиков.
Антибактериальные препараты содержат вещества, разрушающие структуру и прекращающие синтез белка бактерий, поэтому их активно используют в лечении большинства заболеваний. Однако антибиотики приносят не только пользу, но и вред. Он заключается в воздействии не только на болезнетворные, но и на полезные бактерии, необходимые для нормальной деятельности кишечника и крепкого иммунитета.
Однако антибиотики приносят не только пользу, но и вред. Он заключается в воздействии не только на болезнетворные, но и на полезные бактерии, необходимые для нормальной деятельности кишечника и крепкого иммунитета.
Правила питания после лечения антибактериальными препаратами
Восстановить баланс микрофлоры кишечника и избавиться от дисбактериоза поможет диета после приема антибиотиков. Рекомендуется включать в рацион:
- бульоны из куриного мяса и белой рыбы,
- котлеты и тефтели из нежирного мяса,
- рисовые каши,
- картофель, морковь и другие овощи в отварном виде,
- свежие огурцы,
- зелень — петрушку, кинзу, укроп,
- ягоды — землянику, бруснику и малину,
- кисели,
- кефир, творог, йогурты без вкусовых добавок,
- на десерт — мед в небольшом количестве.
Запрещены к употреблению следующие продукты:
- острые приправы — горчица, перец,
- копчености и соленья,
- все жирные и жареные блюда с добавлением пряностей,
- мясо в маринаде,
- колбасные изделия,
- консервы,
- квас, спиртные и газированные напитки.

При строгом соблюдении диеты после приема антибиотиков восстанавливается нормальный стул, исчезают нарушения пищеварения, прекращаются боли в животе.
Препараты для нормализации пищеварительных процессов
Чтобы ускорить восстановление организма после приема антибиотиков, в дополнение к диете специалисты рекомендуют принимать препараты пробиотики. Они оказывают комплексное воздействие:
- участвуют в синтезе ферментов пищеварения, витаминов и важнейших аминокислот,
- стимулируют рост полезной микрофлоры,
- способствуют нормализации стула.
Пробиотики для детей после антибиотиков так же важны, как и для взрослых. Главное — подобрать средство с клинически доказанной эффективностью. Стандартам качества и безопасности отвечают биокомплексы БАК-СЕТ:
Мульти-пробиотики БАК-СЕТ содержат бактерии, которые хорошо выживают в кислой среде и сохраняют активность до конца срока годности. Удобную упаковку не нужно хранить в холодильнике и можно взять с собой куда угодно. Перед применением ознакомьтесь с инструкцией.
Удобную упаковку не нужно хранить в холодильнике и можно взять с собой куда угодно. Перед применением ознакомьтесь с инструкцией.
Зачем пить пробиотики при приеме антибиотиков?
Антибиотики помогают побеждать даже те болезни, которые еще недавно считались смертельными. Однако лекарства приносят организму не только пользу, но и вред. Например, вызывают дисбактериоз.
Прием антибиотиков
Все статьи по темеВсе о дисбактериозе | Медицинский центр «Новая медицина»
ВСЁ О ДИСБАКТЕРИОЗЕ
Дисбактериоз очень распространенное заболевание. По данным Минздрава дисбактериоз выявляют у 90% взрослого населения и свыше 25% детей в возрасте до года. Многие заболевания, в том числе и хронические, связаны с нарушением микробиоценоза кишечника и часто являются следствием дисбактериоза, а не его причиной.
Дисбактериоз считается основной социальной болезнью 21-го века. Актуальность проблемы требует постоянного поиска новых средств лечения дисбактериоза и его коррекции.
ДИСБАКТЕРИОЗ У ДЕТЕЙ
Дисбактериоз у детей, как и у взрослых, возникает вследствие нарушения баланса микрофлоры кишечника. Определить его наличие без анализа в лаборатории крайне сложно, поскольку это не является самостоятельным заболеванием, а возникает вследствие воспалительного процесса в организме или же в случае нарушения баланса витаминов. В медицинской терминологии также применяется определение «дисбиоз», которое является синонимом «дисбактериоза».
Чаще всего возникает дисбактериоз у детей грудного возраста. К основному фактору его появления относится искусственное вскармливание малыша и недостаток витаминов, получаемых с дополнительной пищей. Также дисбактериоз у детей может возникнуть при аллергических реакциях организма, приема антибиотиков, зоны повышенной радиации, острых и хронических заболеваний пищеварительной системы или нарушения нормального функционирования кишечника из-за недостатка бактерий, расщепляющих кислоты и питательные вещества. Источник, как правило, устанавливает врач.
Источник, как правило, устанавливает врач.
Кишечно-желудочный тракт взрослого человека содержит примерно 1,5 кг бактерий, около 400—500 разных видов, а у детей до двух лет, вскармливаемых грудным молоком, преобладают в основной массе бифидобактерии, которые препятствуют развитию кишечно-желудочных заболеваний. У малышей, которых вскармливают искусственным путем, из-за невозможности кормить грудью, не формируется преобладание какой-то определенной группы бактерий — бифидо бактерий, такое питание не сможет предотвратить дисбактериоз у ребенка и защитить организм от других заболеваний. Поэтому врачи рекомендуют кормить теми кисломолочными смесями, которые способствуют их размножению. Информацию о свойствах смесей можно прочитать на упаковке и выбрать оптимальную для ребенка.
Преобладание бифидобактерий в детском организме важно тем, что они помогают регулировать обмен желчных кислот, а также принимают участие в формировании органических веществ и кислот, необходимых для работы кишечника. Способствуют усваиванию витаминов К, группы В, D, солей, никотиновой и фолиевой кислоты, получаемых с питанием. Имеют антиаллергическое, антирахитическое и антианемическое действие на организм, а кроме того формируют иммунитет.
Способствуют усваиванию витаминов К, группы В, D, солей, никотиновой и фолиевой кислоты, получаемых с питанием. Имеют антиаллергическое, антирахитическое и антианемическое действие на организм, а кроме того формируют иммунитет.
Как мы уже говорили, симптомов, по которым можно однозначно сделать вывод, что это дисбактериоз — нет, поэтому нужно искать в первую очередь причину — то заболевание, которое может сопровождаться дисбактериозом.
Раньше дисбактериоз определяли с помощью анализа состава кала, но так как осуществить правильный сбор кала в стерильную посуду не возможно, результат такого анализа не до конца объективен. На сегодняшний день в современной медицине применяются более сложные и точные методы, такие как исследование с помощью биохимии; для гастроскопии — анализ соскоба слизистой 12-перстнойлибо тощей кишки, для колоноскопии — анализ соскоба прямой и толстой кишки. Но такие сложные исследования проводятся только по назначению лечащего врача.
Каким же образом происходит лечение?
Первостепенно необходимо лечить причину его возникновения — основное заболевание, которое устанавливает один из врачей, назначенных педиатром. Курс лечения будет состоять из лечения очага заболевания и специализированного питания смесями, способствующими либо образованию правильной (здоровой) микрофлоры кишечника либо смесями, которые уже содержат микроорганизмы.
Курс лечения будет состоять из лечения очага заболевания и специализированного питания смесями, способствующими либо образованию правильной (здоровой) микрофлоры кишечника либо смесями, которые уже содержат микроорганизмы.
Предотвращается возможный дисбактериоз у ребенка в первую очередь длительным грудным кормлением и своевременным введением дополнительного прикорма к молоку. Лучше всего все этапы вскармливания ребенка согласовывать с наблюдающим педиатром, собственная интуиция важна, но совет профессионала не менее важен, тем более в этом возрасте закладывается основа иммунитета на всю жизнь. Дополнять рацион питания рекомендуется специальными кисло-молочными смесями, которые содержат в себе бифидо и лактобактерии полезные деткам.
В том случае, если врач установил дисбактериоз у ребенка, к основному питанию добавляются кисло-молочные продукты, в зависимости от направления лечения. Наринэ-Форте, Биовестин, Биовестин-лакто содержат бифидо и лактобактерии в пропорциях и состояние, которые способны стимулировать развитие микроорганизмов нормальной флоры.
Но не забывайте — не только питанием лечится дисбактериоз у детей, а также предупреждением первоисточника его возникновения, который определяет врач. Лучше всего сразу применять смеси, которые способствуют образованию бифидобактерий, как прикорм к основному питанию, для того, чтобы поддерживать необходимую микрофлору кишечника и предотвратить дисбактериоз у ребенка, а именно лечение смесями уже осуществлять под руководством врача в сочетании с лечением очага воспаления.
ДИСБАКТЕРИОЗ — ВРАГ ЗДОРОВЬЯ
Каждый день наш организм нуждается в еде. Без пищи человек не может существовать. Прием пищи становится ритуалом, который человек должен соблюдать изо дня в день. Однако не всегда наш организм в силе переварить ее. Особенно, если мы позволяем себе лишнего.
Например, переедаем за ужином или перед сном, едим не совсем полезную и здоровую пищу. Полноценное пищеварение возможно только в случае наличия в желудке каждого человека самых разнообразных микробов. Причем эти микробы могут быть как положительными, так и, как это ни странно, отрицательными. Именно они помогают нашему желудку все это переварить.
Именно они помогают нашему желудку все это переварить.
Если говорить о дисбактериозе, то это состояние, во время которого все микробы нашего организма изменяют свой состав. Это изменение в свою очередь ведет к нарушению работы желудка и кишечника.
Вполне правильным будет вопрос — почему же все это происходит? Изменение состава Вашего кишечника происходит в результате каких-либо изменений в Вашем организме. Что это значит? Ваш организм чем-то заражен или в него попала какая-то инфекция. Все это приводит к появлению дисбактериоза.
Рассмотрим подробнее причины появления дисбактериоза. Этот сбой работы кишечника может произойти в результате неправильного применения различных антибиотиков. Если Вы страдаете заболеваниями пищеварительного тракта, у Вас также может появиться дисбактериоз. Слабый иммунитет, послеоперационное состояние или неправильное питание — еще три причины появления дисбактериоза.
Во время дисбактериоза кишечник перестает обладать полезными микробами..gif) Он наполнен только вредными бактериями, которые приводят к болям в области кишечника. В этот момент организм человека практически не получает никаких витаминов, жиров и других важных для организма веществ. Все это приводит к сильному снижению веса больного. При дисбактериозе у больного болит и вздувается живот. У него обязательно меняется стул.
Он наполнен только вредными бактериями, которые приводят к болям в области кишечника. В этот момент организм человека практически не получает никаких витаминов, жиров и других важных для организма веществ. Все это приводит к сильному снижению веса больного. При дисбактериозе у больного болит и вздувается живот. У него обязательно меняется стул.
Чтобы выявить наличие этого заболевания, Вам необходимо обратиться к врачу-гастроэнтерологу. Он назначит Вам гастроскопию, то есть проверят Ваш кишечник при помощи специального аппарата. Вам также проверят кишку и возьмут анализы кала. Все эти процедуры помогут врачу назначить Вам правильный курс лечения.
При любом курсе лечения этого заболевания Вы должны будете соблюдать диету. Эта диета обязательно будет включать в свой состав различные продукты, которые богаты полезными бактериями. Чаще всего таковыми являются различные кисломолочные продукты. Также Вам пропишут антибиотики или бактериофаги. Это препараты, которые помогут Вам очистить кишечник от вредных бактерий. Также Ваше лечение не обойдется без лекарственных препаратов, которые помогут Вашему кишечнику нормализоваться. Это такие препараты как: Нарине-Форте, Бификол, Биовестин, Нарине Ф-баланс и др.
Также Ваше лечение не обойдется без лекарственных препаратов, которые помогут Вашему кишечнику нормализоваться. Это такие препараты как: Нарине-Форте, Бификол, Биовестин, Нарине Ф-баланс и др.
Чаще всего для полного выздоровления хватает двух месяцев. Однако есть одно но. Как правило, после лечения ни один врач не даст Вам стопроцентной гарантии, что Вы не заболеете дисбактериозом вновь. Микрофлора кишечника имеет один большой минус. Она очень быстро реагирует на любые изменения Вашего организма. Чтобы избежать всех этих неприятностей, Вам необходимо вовремя избавляться от любых неполадок Вашего органи. Например можно проводить профилактику — время от времени пропивать препараты, которые нормализуют микрофлору кишечника. Для этих целей отлично подойдет Нарине-Форте или Нарине Ф-баланс. При регулярном применение эти препараты не дадут развиться дисбактериозу, а так же нормализуют микрофлору пищеварительного тракта, что улучшит аппетит, стул и защитит Ваш кишечник от патогенных микробов. Также Вам не стоит принимать никакие антибиотики без консультации у врача.
Также Вам не стоит принимать никакие антибиотики без консультации у врача.
Если говорить честно, то все в Ваших руках. Здоровье каждого человека в огромнейшей степени зависит исключительно от него самого. Если Вы будете себя беречь, Вы навсегда останетесь здоровыми и счастливыми.
БАД — ЭТО ТО, ЧТО НАМ НЕ ХВАТАЕТ В ПИЩЕ?
Относятся ли БАДы к разряду медикаментозных препаратов? Вызывают ли пищевые добавки привыкание? Могут ли добавки заменить обычное питание? Как правильно их применять? Что входит в их состав? Есть ли у БАДов противопоказания, и в каких случаях необходимо посоветоваться с врачом, прежде чем их принимать? На вопросы отвечает директор направления по улучшению качества пищевых продуктов канадского Института Здоровья Nutrilite.
Кто из нас не мечтает укрепить здоровье и продлить отпущенный природой срок жизни? Для этих целей вроде бы и выпускаются различные биологически активные добавки (БАДы). О них ходит множество мифов. Кто-то считает их панацеей от всего, кто-то убежден, что они не дают никакого эффекта, а их производители — шарлатаны…
Так что же такое БАДы и как правильно их принимать? С этим вопросом «Правда. ру» обратилась к Одре Дэвис — директору направления по улучшению качества пищевых продуктов канадского Института Здоровья Nutrilite.
ру» обратилась к Одре Дэвис — директору направления по улучшению качества пищевых продуктов канадского Института Здоровья Nutrilite.
— Относятся ли БАДы к разряду медикаментозных препаратов?
— Биологически активные добавки к пище — не лекарства. Но использовать их в комплексе с лекарственными средствами вполне разумно и оправданно. Они помогают оздоровить организм, сократить длительность болезни, снизить риск развития осложнений и обострений, позволяют увеличить продолжительность жизни. Лекарства хороши, когда человек уже заболел. А БАДы применяются как средства профилактики, предупреждения болезней. Ведь, за исключением травм и инфекций, болезнь никогда не возникает внезапно. Зачастую развитие заболевания являет собой длительный процесс, на протяжении которого организм пытается бороться с патологическими изменениями… Если в это время прибегнуть к БАДам, возможно, удастся восстановить нормальную работу органов еще до того, как нарушения станут очевидны.
— Вызывают ли пищевые добавки привыкание?
— Физиологического привыкания не вызывают..gif) Но есть люди, «зацикленные» на приеме различных витаминов, добавок и лекарств. На самом деле в состав добавок входят вещества, которые должны присутствовать в нашем ежедневном рационе. Но мало кто из нас умеет питаться рационально. Вот и бежим покупать БАДы!
Но есть люди, «зацикленные» на приеме различных витаминов, добавок и лекарств. На самом деле в состав добавок входят вещества, которые должны присутствовать в нашем ежедневном рационе. Но мало кто из нас умеет питаться рационально. Вот и бежим покупать БАДы!
— Могут ли добавки заменить обычное питание? Как правильно их применять?
— БАДы являются именно добавками к пище, а не ее заменителями. С их помощью организм адаптируется к воздействию различных внешних и внутренних факторов. Биодобавки и витаминно-минеральные комплексы рекомендуется принимать регулярно в осенно-зимне-весенний период, когда организм ослаблен непогодой и гиповитоминозами. Кроме того, они могут оказать незаменимую помощь в восстановлении после стрессов и физических нагрузок.
— А что входит в их состав?
— БАДы включают в себя компоненты животного, растительного и минерального происхождения. В их состав могут входить как природные ингредиенты, так и соединения, полученные биотехнологическими или химическими методами. Могу с уверенностью сказать, что генетически модифицированные продукты при производстве биологически активных добавок не используются. В России утвержден и действует список из 190 разрешенных компонентов. Есть и перечень запрещенных: это, во-первых, сильнодействующие психотропные и ядовитые вещества, а также вещества, не являющиеся аналогами элементов нашего пищевого рациона, неприродные синтетические продукты, гормоны и ряд других…
— Есть ли у БАДов противопоказания, и в каких случаях необходимо посоветоваться с врачом, прежде чем их принимать?
— Предупреждения о возможных противопоказаниях потребитель может прочитать на этикетке к препарату. В России БАДы обязательно проходят государственную регистрацию. Но за консультацией к врачу не мешает обратиться, если вы беременны, кормите грудью, а также, если препарат предназначается для ребенка. Стоит помнить и о том, что у разных людей организм может по-разному реагировать на те или иные продукты и препараты, даже, на первый взгляд, безвредные. Поэтому совет грамотного специалиста никогда не помешает.
РОДИТЕЛЯМ ОБ АНТИБИОТИКАХ
Вторую половину ХХ века можно смело назвать антибактериальной эрой, и это не будет преувеличением: число жизней, спасенных с помощью антибиотиков, давно перешагнуло за миллиард! Об их чудотворной силе ходят легенды, но и хулы в их адрес приходится слышать не меньше. Виной тому поверхностное знание, провоцирующее неоправданные ожидания, а стало быть — и многочисленные обвинения антибиотиков в бедах, за которые они на самом деле ответственности вовсе не несут.
А хуже всего то, что антибиотики применяют гораздо чаще, чем это необходимо, нанося тем самым серьезнейший вред не только больным, но и обществу в целом. Я далек от мысли научить родителей самостоятельно использовать антибиотики — это дело врача. Но я убежден, что понимать логику назначения врача современные родители не только могут, но и обязаны.
О ПОЛЬЗЕ ГРЯЗНОЙ ПОСУДЫ
Слово «антибиотик» образовано из двух элементов греческого происхождения: anti- — «против» и bios — «жизнь». Антибиотиками называют образуемые микроорганизмами, высшими растениями или тканями животных организмов вещества, избирательно подавляющие развитие микроорганизмов (или клеток злокачественных опухолей).
Любопытна история открытия первого антибиотика — пенициллина — шотландским бактериологом Александером Флемингом в 1829 г.: будучи по природе человеком неряшливым, он очень не любил… мыть чашки с бактериологическими культурами. Каждые 2—3 недели на его рабочем столе вырастала целая груда грязных чашек, и он скрепя сердце приступал к очистке «авгиевых конюшен». Одна из таких акций дала неожиданный результат, масштаб последствий которого сам ученый оценить в тот момент не мог. В одной из чашек обнаружилась плесень, подавляющая рост высеянной культуры болезнетворной бактерии группы staphylococcus. Кроме того, «бульон», на котором разрослась плесень, приобрел отчетливо выраженные бактерицидные свойства по отношению ко многим распространенным патогенным бактериям. Плесень, которой была заражена культура, относилась к виду penicillium.
В очищенном виде пенициллин был получен лишь в 1940 г., т. е. спустя 11 лет после его открытия, в Великобритании. Сказать, что это произвело революцию в медицине, — значит не сказать ничего. Но у любой медали, увы, две стороны…
ОБОРОТНАЯ СТОРОНА МЕДАЛИ
Открыв столь мощное оружие в борьбе с болезнетворными микроорганизмами, человечество впало в эйфорию: к чему долго и кропотливо подбирать лекарственную терапию, если можно «шарахнуть» по зловредным микробам антибиотиком? Но и микробы «не лыком шиты» — они весьма эффективно защищаются от грозного оружия, вырабатывая устойчивость к нему. Если антибиотик, скажем, блокирует синтез необходимых микробу белков — микроб в ответ на это просто… меняет белок, обеспечивающий его жизнедеятельность. Некоторые микроорганизмы ухитряются научиться выработке ферментов, разрушающих сам антибиотик. Короче говоря, способов множество, и «хитроумные» микробы ни одним из них не пренебрегают. Но самое печальное заключается в том, что устойчивость микробов может передаваться от одного вида другому путем межвидового скрещивания! Чем чаще применяется антибиотик, тем быстрее и успешнее микробы приспосабливаются к нему. Возникает, как вы понимаете, порочный круг — чтобы разорвать его, ученые вынуждены вступить в навязанную микробами «гонку вооружений», создавая все новые и новые виды антибиотиков.
НОВОЕ ПОКОЛЕНИЕ ВЫБИРАЕТ…
К настоящему времени создано более 200 противомикробных препаратов, из них более 150 используются для лечения детей. Их мудреные названия нередко ставят в тупик людей, не имеющих отношения к медицине. Как же разобраться в обилии замысловатых терминов? На помощь, как всегда, приходит классификация. Все антибиотики делятся на группы — в зависимости от способа воздействия на микроорганизмы.
Пенициллины и цефалоспорины разрушают оболочку бактериальной клетки.
Аминогликозиды, макролиды, левомицетин, рифампицин и линкомицин убивают бактерии, подавляя синтез разных ферментов — каждый своего.
Фторхинолоны уничтожают микроорганизмы более «изощренно»: подавляемый ими фермент отвечает за размножение микробов.
В непрекращающемся состязании с микробами ученым приходится придумывать все новые и новые методы борьбы — каждый из них дает начало новому поколению соответствующей группы антибиотиков.
Теперь о названиях. Увы, здесь царит изрядная неразбериха. Дело в том, что помимо основных международных (так называемых генерических) названий многие антибиотики имеют и фирменные, запатентованные тем или иным конкретным производителем (в России их более 600). Так, например, один и тот же препарат может называться амоксициллином, Оспамоксом и Флемоксин Солютабом. Как же разобраться? По закону наряду с патентованным фирменным названием на упаковке лекарства обязательно указывается и его генерическое название — мелким шрифтом, нередко по-латыни (в данном случае — amoxycillinum).
При назначении антибиотика часто говорят о препаратепервого выбора и резервных препаратах. Препарат первого выбора — это тот препарат, назначение которого определяется диагнозом — если у больного нет устойчивости или аллергии к этому лекарственному средству. В последнем случае обычно назначаются резервные препараты.
ЧЕГО ЖДАТЬ И ЧЕГО НЕ ЖДАТЬ ОТ АНТИБИОТИКОВ?
Антибиотики способны излечить заболевание, вызванное бактериями, грибками и простейшими, но не вирусами. Именно поэтому бесполезно ожидать эффекта от антибиотика, назначенного при ОРВИ, точнее, эффект в таких случаях бывает негативным: температура держится несмотря на прием антибиотика — вот вам и «питательная среда» для распространения молвы о якобы потерянной эффективности антибиотиков или же о повальной устойчивости микробов.
Назначение антибиотика при вирусной инфекции не предотвращает бактериальных осложнений. Напротив, подавляя рост чувствительных к препарату микробов, например обитающих в дыхательных путях, антибиотик облегчает заселение дыхательных путей устойчивыми к нему патогенными бактериями, легко вызывающими осложнение.
Антибиотики не подавляют воспалительного процесса, обусловливающего подъем температуры, так что «сбить температуру» через полчаса, как парацетамол, антибиотик не может. При приеме антибиотика падение температуры наступает лишь через несколько часов или даже через 1—3 дня. Именно поэтому нельзя давать одновременно антибиотик и жаропонижающее: падение температуры от парацетамола может замаскировать отсутствие эффекта от антибиотика, а при отсутствии эффекта антибиотик, естественно, необходимо как можно скорее сменить.
Однако сохранение температуры нельзя считать признаком, однозначно свидетельствующим о неэффективности принимаемого антибиотика: порой выраженная воспалительная реакция, образование гноя требуют дополнительного к антибактериальному лечения (назначения противовоспалительных средств, вскрытия гнойника).
ВЫБОР ЗА ВРАЧОМ
Для лечения заболеваний, вызываемых чувствительными к антибиотикам микробами, обычно используются препараты первого выбора. Так, ангину, отит, пневмонию лечат амоксициллином или оспеном, микоплазменную инфекцию или хламидиоз эритромицином или другим антибиотиком из группы макролидов.
Возбудители кишечных инфекций зачастую быстро вырабатывают устойчивость к антибиотикам, поэтому при лечении кишечных инфекций антибиотики применяются лишь в тяжелых случаях — обычно цефалоспорины 2—3-го поколений или хинолоны.
Инфекции мочевых путей вызываются представителями кишечной флоры, их лечат амоксициллином или, при устойчивости возбудителей, резервными препаратами.
Как долго принимают антибиотик? При большинстве острых болезней его дают в течение 2—3 дней после падения температуры, однако есть много исключений. Так, отит обычно лечат амоксициллином не более 7—10 дней, а ангину — не менее 10 дней, иначе может быть рецидив.
ТАБЛЕТКИ, СИРОПЫ, МАЗИ, КАПЛИ…
Для детей особенно удобны препараты в детских формах. Так, препарат амоксициллина Флемоксин Солютаб выпускается в растворимых таблетках, их легко дать с молоком или чаем. Многие препараты, такие как джосамицин (Вильпрафен), азитромицин (Сумамед), цефуроксим (Зиннат), амоксициллин (Оспамокс) и др., выпускаются в сиропе или в гранулах для его приготовления.
Есть несколько форм антибиотиков для наружного применения — левомицетиновая, гентамициновая, эритромициновая мази, тобрамициновые глазные капли и др.
ОПАСНЫЕ ДРУЗЬЯ
Опасности, связанные с приемом антибиотиков, часто преувеличивают, но помнить о них необходимо всегда.
Поскольку антибиотики подавляют нормальную флору организма, они могут вызывать дисбактериоз, т. е. размножение бактерий или грибов, не свойственных тому или иному органу, прежде всего кишечнику. Однако лишь в редких случаях такой дисбактериоз опасен: при недлительном (1—3 недели) лечении антибиотиками проявления дисбактериоза фиксируются крайне редко, к тому же пенициллин, макролиды, цефалоспорины 1-го поколения не подавляют роста флоры кишечника. Так что противогрибковые (нистатин) и бактериальные (Бифидумбактерин, Лактобактерин) препараты применяются для предупреждения дисбактериоза лишь в случаях длительного лечения несколькими лекарственными препаратами широкого антибактериального спектра.
Термином «дисбактериоз», однако, в последнее время стали злоупотреблять — ставят его в качестве диагноза, списывая на него чуть ли не любые нарушения функционирования желудочно-кишечного тракта. Есть ли вред от такого злоупотребления? Да, поскольку это мешает постановке правильного диагноза. Так, например, у многих детей с пищевой непереносимостью диагностируют дисбактериоз, а потом «лечат» Бифидумбактерином, обычно без успеха. Да и стоят анализы кала на дисбактериоз немало.
Еще одна опасность, подстерегающая при приеме антибиотиков, — аллергия. У некоторых людей (в том числе и у грудных детей) имеется аллергия к пенициллинам и другим препаратам-антибиотикам: сыпи, шоковые реакции (последние, к счастью, встречаются очень редко). Если у вашего ребенка уже наблюдалась реакция на тот или иной антибиотик, об этом надо обязательно сообщить врачу, и он легко подберет замену. Особенно часты аллергические реакции в тех случаях, когда антибиотик дают больному, страдающему заболеванием небактериальной природы: дело в том, что многие бактериальные инфекции как бы снижают «аллергическую готовность» больного, что уменьшает риск реакции на антибиотик.
Аминогликозиды могут вызывать поражение почек и глухоту, их без большой надобности их не применяют. Тетрациклины окрашивают эмаль растущих зубов, их дают детям только после 8 лет. Препараты фторхинолонов детям не назначают из-за опасности нарушения роста, их дают лишь по жизненным показаниям.
Принимая во внимание все вышеперечисленные «факторы риска», врач обязательно оценивает вероятность осложнений и применяет препарат только тогда, когда отказ от лечения сопряжен с большой степенью риска.
В заключение остается лишь сказать несколько слов об экономических аспектах назначения антибиотиков. Новые антибиотики стоят очень дорого. Спору нет, бывают ситуации, когда их применение необходимо, однако я часто сталкиваюсь со случаями, когда эти препараты назначаются без надобности, при заболеваниях, которые можно легко вылечить дешевыми лекарствами «старого образца». Я согласен с тем, что не следует скупиться, если речь идет о лечении ребенка. Но траты должны быть разумными! (Можно, например, купить антибиотик в форме сиропа: сиропы довольно дороги, но дети их принимают охотно, да и дозировать сироп или капли очень удобно.) Однако это не означает, что при выборе препарата вовсе не следует принимать во внимание финансовую сторону дела. Не надо стесняться спросить у врача, во что обойдется вам выписанный рецепт, и если он вас не устраивает (слишком дорог или слишком дешев — это тоже нередко настораживает родителей), поищите вместе с врачом удовлетворяющую вас замену. Хочу еще раз повторить: десятки препаратов, имеющиеся сегодня в аптеках, почти всегда позволяют найти эффективное лекарство, соответствующее вашим возможностям.
ДИСБАКТЕРИОЗ — АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Проблема сохранения здоровья, поиск путей снижения неблагоприятного воздействия на организм внешней среды являются в настоящее время крайне актуальными для нашей страны. По данным Российской академии наук, более 90% населения Российской Федерации в настоящее время имеют отклонения от физиологической нормы по тем или иным показателям, характеризующим здоровье человека.
Техногенные и экологические катастрофы, инфекционные болезни, экспансия некачественных лекарственных средств и продуктов питания, самоотравление алкоголем и наркотиками, психоэмоциональное напряжение и множество других вредоносных факторов истощают защитные силы организма, снижают его адаптационный потенциал.
Одной из важнейших систем поддержания и сохранения гомеостаза организма является его нормальная микрофлора, населяющая желудочно-кишечный тракт, мочеполовую систему, кожные покровы. Она оказывает многоплановое влияние на защитные, адаптационные и обменно-трофические механизмы организма, а ее нарушения под влиянием факторов эндогенной или экзогенной природы могут привести к утрате или искажению этих функций, которые влекут за собой проявления дисбактериоза — изменения качественного и количественного состава микрофлоры организма. Спектр клинических синдромов и патологических состояний, патогенез которых связан с дисбактериозом, в настоящее время очень широк и имеет тенденцию к увеличению.
Это возводит проблему разработки средств, повышающих адаптационный потенциал организма человека, в ранг первостепенных задач не только медицинского, но и экономического и политического характера.
В настоящее время одним из наиболее доступных и эффективных способов экологической реабилитации являются пробиотики — продукты, биологически активные добавки и фармацевтические препараты на основе полезных микроорганизмов, прежде всего, бифидобактерий и лактобацилл, оказывающих многофакторное регулирующее и стимулирующее воздействиие на организм человека, укрепляющих иммунную систему, защищающих от болезнетворных микробов. И не случайно, согласно данным российских маркетологов, занятых анализом объемов потребления фармпрепаратов и БАД, начиная с 2000 года только два сегмента этого рынка имеют тенденцию к росту — антиканцерогенные и пробиотические препараты. Им принадлежит ведущая роль в нормализации микробиоценоза кишечника, поддержании неспецифической резистентности организма, улучшении процессов всасывания и гидролиза жиров, белкового и минерального обмена, синтезе биологически активных веществ.
Представители нормофлоры синтезируют витамины группы В, никотиновую кислоту, биотин, витамин К. Большая роль принадлежит им в защите организма от токсических элементов экзогенного происхождения и эндогенных субстратов и метаболитов. Они принимают активное участие в метаболизации разнообразных веществ растительного, животного и микробного происхождения, рециркуляции желчных кислот, активно влияют на метаболизм билирубина и холестерина. Установлена их антиканцерогенная и антимутагенная активность. Известна способность инактивировать гистамин, играющий важную роль в проявлении аллергии.
Все эти положительные эффекты позволяют рассматривать представителей нормальной микрофлоры как эффективный биокорректор и основу для создания различных форм пробиотиков.
По материалам сайта www.disbakterioza.net
Лекарство от дисбактериоза – как выбрать лучший препарат?
Проблемы со стулом, неприятное чувство в животе может быть связано не только с отравлением пищей. У взрослых и детей за этими симптомами часто скрывается дисбактериоз. Врачи не считают его заболеванием, это состояние часто сопровождает другие патологии или является их следствием. Но устранять нарушение микрофлоры нужно как можно раньше.
Что такое дисбактериоз
Ребенок появляется на свет стерильным, в его организме в норме нет бактерий. Кишечник, кожа заселяются постепенно, начиная с первого прикладывания младенца к груди. Чем старше становится ребенок и более разнообразна его пища, тем больше различных бактерий попадают в кишечник и формируют его микрофлору. У взрослых людей состав микроорганизмов стабилизируется, но становится разнообразным. Его можно сравнить с отпечатком пальцев, несмотря на сходство, он не повторяется ни у одного человека.
Среди кишечных бактерий насчитывается сотни видов хороших микроорганизмов, но в норме встречаются и плохие, рост которых организм может сдерживать. Условно выделяют три типа микробов:
- доминирующие – присутствуют у всех здоровых людей, к ним относятся эубактеры, бактероиды, бифидобактерии, лактобактерии;
- непостоянные виды – встречаются не у всех или при определенных условиях, это стрептококки, кишечная палочка, протей, цитобактер;
- транзиторные виды – иногда попадают в кишечник, но долго там не задерживаются, это такие типы, как дрожжевые грибы, клостридии, синегнойная палочка.
Хорошими микроорганизмами являются доминирующие бактерии, их должно быть большинство. Благодаря присутствию нормальной микрофлоры переваривается пища. Бактерии помогают ферментировать некоторые неперевариваемые продукты, участвуют в всасывании витаминов, аминокислот, сахаров. Сами они тоже синтезируют витамины группы В, К, жирные кислоты. Поэтому при дисбактериозе появляются признаки гиповитаминоза.
Хорошие бактерии выполняют роль живого щита. Они формируют защитный слой на кишечной стенке, которые не позволяет прикрепиться патогенным микроорганизмам и ограничивает их в питательных веществах. Иммунная функция заключается в тренировке клеток иммунитета и регуляции его ответа на проникновение чужеродных микроорганизмов или белков.
Но при изменении соотношения бактерий, увеличении количества транзиторных видов, появлении дрожжевых грибков, развивается дисбактериоз. Его нельзя назвать заболеванием, но самочувствие у человека нарушается. При дисбактериозе в кишечнике нет патогенных микроорганизмов (сальмонелл, холерного вибриона, иерсиний, патогенных эшерихий, а также вирусов). Изменения состава происходят за счет дисбаланса нормальной флоры и увеличения концентрации условно-патогенных бактерий, появления грибков.
Причины
Микрофлора кишечника у взрослых находится в состоянии динамического равновесия. В нем присутствуют определенные бактерии, которые составляют большинство, и около 3 % микроорганизмов, которые меняют свой состав. В норме колебания происходят под влиянием продуктов питания и пищевых привычек. На микрофлору влияет преобладание в рационе сладкого и жирного или преимущественно растительная пища.
Исследования показывают, что жирная еда угнетает бифидобактерии и энтерококки, но в этих условиях размножаются бактероиды. Преимущественно углеводная диета стимулирует размножение бифидобактерий и общего количество микроорганизмов. Но таки перемены носят временный характер и не ведут к появлению симптомов дисбактериоза. Они сами исчезают после изменения питания.
Дисбактериоз кишечника у взрослых появляется в результате других заболеваний. Основными причинами нарушения микрофлоры являются:
- длительное лечение антибиотиками;
- патологии вышележащих отделов пищеварительного тракта;
- продолжительные монодиеты и постоянное неправильное питание;
- кишечные инфекции.
Антибиотики широкого спектра действия действуют неселективно. Они угнетают рост или вызывают гибель всех микроорганизмов. Чем дольше курс лечения, тем выше вероятность, что после него разовьется дисбактериоз. Особенно опасны тетрациклиновые антибиотики. Они значительно угнетают размножение кишечной микрофлоры, что приводит к гиповитаминозу В, К, увеличению риска кровотечений.
Гастрит, холецистит, панкреатит, гепатит или дискинезия желчных путей могут привести к развитию дисбактериоза. Опасны цирроз печени, опухолевые процессы в желудке или язва. Эти патологии сопровождаются нарушением переваривания пищи, выработки ферментов. Поэтому в кишечник пища поступает недостаточно обработанной и не может служить питательной средой для бактерий. Часть из них гибнет, а на их место приходит словно-патогенная флора.
Разгрузочный день, когда рацион строится на употреблении одного продукта питания, не наносит вреда организму. Но монодиета, которая длится несколько недель или становится образом жизни, может привести к дисбактериозу. Опасно постоянное употребление еды, содержащей простые углеводы, животные жиры. Это сладкое, мучное, блюда из фаст-фуда. Такой рацион угнетает размножение нормальной флоры, в кишечнике активируются процессы брожения, появляется большое количество дрожжевых грибков.
Двойной вред кишечнику наносят пищевые инфекции. Они повреждают слизистую оболочку, а лечение антибиотиками убивает полезные бактерии. Поэтому восстановление после болезни проходит особенно тяжело.
Негативно на состояние кишечника влияет курение. Оно создает условия для размножения дрожжевых грибков, поэтому курильщики часто мучаются неприятными симптомами.
Симптомы дисбактериоза
Нет строгих симптомов, которые с большой вероятностью указывают на дисбактериоз. Проявления патологии часто не соответствуют степени тяжести нарушений. Самый частый признак – нарушение пищеварения по типу кишечной диспепсии. Она проявляется следующими симптомами:
- урчание в животе;
- метеоризм, усиленное газообразование;
- вздутие живота;
- нарушения стула;
- появление в кале патологических примесей.
Усиление газообразования на начальном этапе происходит после нарушения питания. Если в определенный день в рационе присутствовало молоко, бобовые, большое количество мучного и сладкого, симптомы проявляются ярко.
Нарушения стула изменчивы. Чаще всего дисбактериоз проявляется диареей. Она может сопровождаться спазмами и болью в животе. Иногда неоформленный стул появляется всего раз в сутки, поэтому не попадает под критерий диареи.
Понос может сменяться запором. Такой процесс наблюдается у людей, которые ограничивают количество клетчатки и пищевых волокон в рационе. Это лишает бактерии необходимых питательных веществ, не позволяет удерживать в просвете кишечника воду. Слизистые патологические примеси в каловых массах, боль в животе появляются при запущенных формах дисбактериоза.
Нарушение состава микрофлоры приводит к дефициту витаминов. Если он не компенсируется при помощи питания или приема поливитаминных препаратов, появляются симптомы гиповитаминоза:
- ухудшается состояние волос, ногтей;
- на коже появляются высыпания;
- проявляются аллергические реакции или пищевая непереносимость;
- повышается утомляемость, снижается работоспособность;
- нарушается сон.
Кишечные микроорганизмы синтезируют витамин К, который участвует в свертывании крови. При гиповитаминозе учащается появление синяков, гематом под кожей от небольшого механического воздействия. При язве желудка, небольших травмах увеличивается риск продолжительного кровотечения.
В тяжелых случаях дисбактериоз, который сопровождается диареей, приводит к обезвоживанию. У многих пациентов снижается масса тела.
Какое нужно обследование
Симптомы дисбактериоза неспецифические. За одинаковыми признаками могут маскироваться патология органов пищеварения или гиповитаминоз. Поэтому дисбактериоз считается клинико-лабораторным синдромом.
Диагностика начинается с копрологического исследования, которое позволяет оценить пищеварительную функцию, состояние ферментных систем, перистальтику и скорость продвижения пищевого комка.
Но изменение состава кала еще не говорит о дисбактериозе. Необходимо подтвердить изменение состава бактерий в просвете кишечника. В Москве во многих клиниках применяют методы газожидкостной и ионной хроматографии. Они позволяют определить состав микрофлоры по полученным метаболитам.
Часто используют бактериологическое исследование. Для этого смывы со слизистой оболочки кишечника, фекалии или соскоб высевают на специальные питательные среды. Этот способ позволяет получить колонии бактерий и с высокой точностью определить их тип. Также используют специальный анализ кала на дисбактериоз. Но обязательное условие – биологический материал должен попасть в лабораторию не позже, чем через час после его получения от пациента. Кал необходимо поддерживать в теплом виде, чтобы не вызвать гибель бактерий. Метод не оправдывает себя тем, что дает представление только о состоянии флоры толстого кишечника.
Золотой стандарт диагностики дисбактериоза – интестиноскопия. Это эндоскопический метод, во время которого в полость тонкой кишки через рот и желудок или прямую и толстую кишку вводят гибкий зонд с видеокамерой. Он необходим для осмотра слизистой кишечника и получения аспирата его содержимого. Полученную жидкость также засевают на питательную среду. Недостаток метода – необходимость общей анестезии, специальных бактериологических сред и долгое ожидание результата. Иногда для диагностики дисбактериоза применяют дыхательный тест с меченным Н2.
Препараты и их действие
Самый эффективный способ восстановить микрофлору и избавиться от дисбактериоза – использовать препараты из группы пробиотиков. Производители предлагают лекарственные средства в разных формах:
- капсулы;
- таблетки;
- порошок;
- капли;
- раствор.
Лекарственную форму подбирает врач в зависимости от возраста пациента. Детям и пожилым людям, которым тяжело глотать таблетки, назначают раствор или порошок для его приготовления. В возрасте 0-3 лет ребенку легче дать капли с пробиотиком. Всем остальным рекомендованы средства в виде капсул или таблеток.
Препараты от дисбактериоза – это лекарства, которые можно приобрести без рецепта врача. Но самолечением заниматься не рекомендуется, только специалист может подсказать, какой тип лучше принимать.
В составе пробиотиков обычно 1-2 типа бактерий, которые хорошо восстанавливают слизистую. Обычно это лакто- и бифидобактерии. Они являются нормальными обитателями кишечника, которые помогают улучшить микробный баланс. Механизм действия этой терапевтической группы связан с подавлением роста патогенной флоры. Молочнокислые бактерии конкурируют за рецепторы на эпителии слизистой оболочки, питательные вещества. Они выделяют молочную кислоту, цитокины, которые оказывают угнетающее действие на патогены.
Эффективно вылечить дисбактериоз помогают препараты из группы пребиотиков. Это лекарства, которые относятся к группе пищевых волокон: инулин и лактулоза, а также препараты на их основе.
Они не расщепляются пищеварительными ферментами и попадают в неизменном виде в толстый кишечник, где становятся питательным субстратом для лакто- и бифидобактерий. Поэтому микробы хорошо размножаются, увеличивают объем бактериальной массы, восстанавливают стенку кишечника. Чтобы лечение было максимально эффективное, рекомендуется пить одновременно пребиотики и пробиотики.
Лечение дисбактериоза не противопоказано при сопутствующих патологиях пищеварительного тракта. Пробиотики не наносят вреда пациентам с язвой желудка, заболеваниями печени или желчного пузыря. А в некоторых случаях они ускорят восстановление.
В запущенных случаях дисбактериоза кишечника и когда симптомы диспепсии слишком мучительны, могут помочь лекарства из группы ферментов. Их должен подбирать врач, в зависимости от типа нарушения пищеварения. Эти средства необходимо пить ежедневно до еды
Сколько времени придется лечить дисбактериоз, сказать тяжело. В некоторых случаях это может растянуться на несколько недель, а при запущенном состоянии – несколько месяцев.
Профилактика дисбактериоза
Даже если использовать эффективные препараты и избавиться от дисбактериоза, нельзя точно сказать, не придется ли его лечить еще раз. Поэтому врачи рекомендуют соблюдать меры профилактики.
Самый эффективный – постоянно придерживаться диеты. Она подбирается в зависимости от типа диспепсии. Универсальное средство профилактики – употреблять продукты, которые содержат естественные пробиотики. К ним относятся крупяные каши, кисломолочные продукты с закваской из бифидобактерий, некоторые сорта хлеба. Если постоянно ощущается брожение в кишечнике, на время терапии нужно исключить из рациона углеводы, молоко, горох и сою. Не рекомендуют употреблять продукты, богатые эфирными маслами. У ним относятся лук, чеснок, редька, редис.
Хорошо пить не менее 1,5 л чистой воды в сутки. Действенный способ стабилизировать состав микрофлоры – принимать растительные соки. В этом помогают морковный, тыквенный, картофельный. Помогают многие растительные продукты: ягоды черники, земляники, абрикосы, клюква. Врач может назначить отвары лекарственных растений. Лечить дисбактериоз при преобладании грибковой флоры можно растворимым цикорием. В некоторых случаях эффективны эвкалипт, календула, соя, зверобой.
В список полезных веществ при дисбактериозе входит инулин. Он ускоряет рост и размножение бифидобактерий, чем помогает увеличить объем полезных микробов в кишечнике. Инулин помогает восстановить слизистую за счет увеличения выработки слизи, изменения степени рН и создания благоприятной среды для бактерий.
К мерам профилактики дисбактериоза относится использование пробиотиков заранее у пациентов, которым необходимо пройти курс лечения антибиотиками или химиотерапию. Это позволяет поддержать нормальный состав микрофлоры и избежать неприятных симптомов после окончания терапии.
Токарева Людмила Георгиевна, врач-терапевт медицинских кабинетов 36,6
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ, ПЕРЕД ПРИМЕНЕНИЕМ НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ
симптомы, диета, лечение в Сочи, клиника «АРМЕД»
Масса микрофлоры желудочно-кишечного тракта составляет 2,5 кг. Нормальная кишечная микрофлора выполняет ряд функций в организме человека. Она является антагонистической по отношению к патогенной и условно патогенной, что предупреждает развитие острой кишечной инфекции, синтезирует витамины, активирует иммунитет.
Термин «дисбактериоз кишечника» включает:
- изменение количественного и качественного состава микрофлоры в тонкой и толстой кишке;
- появление условно патогенных штаммов, не входящих в состав резидентной микрофлоры: Proteus, morganella, Klebsiella, Enterobacter, E.coli (с ферментативной недостаточностью или гемолизирующими свойствами).
Следует отметить, что дисбактериоз (синонимы избыточный бактериальный рост в кишечнике, дисбиоз) не является самостоятельным заболеванием и возникает у пациентов на фоне разных состояний и заболеваний, что следует учитывать в процессе выработки тактики лечения.
По статистике дисбактериоз чаще всего касается маленьких детей или женщин.
Причины возникновения
- Питание: несбалансированность, смена диеты, особенности воды.
- Ятрогения: прием антибиотиков и других лекарственных средств, вакцинация.
- Профессиональные вредности: химические производства, ночной график.
- Окружающая среда: загрязнение, изменение климата, излучение.
- Генетика: наследственность, патология ЖКТ, мутации NOD2.
- Образ жизни: стрессы, нарушения биоритмов.
- Масса тела: ожирение, дефицит веса.
- Заболевания: инфекционные, нервные, эндокринные, иммунные.
Огромное количество трудоспособного активного населения допускает нарушения в режиме питания (в современном ритме жизни человек порой заменяет полноценный завтрак, который должен проходить в неторопливой атмосфере, перекусами на бегу), испытывает частые и хронические стрессы, ведёт прием лекарственных препаратов.
Неправильно спланированное питание, как правило, сочетается с нервной нагрузкой в течение рабочего дня и неблагоприятными факторами: пробки по пути на работу, очереди, стрессы.
В итоге, один из этих факторов, либо их сочетание, становится причиной возникновения множества болезней ЖКТ, в том числе и дисбактериоза.
Клинические проявления дисбактериоза включают местные (кишечные) симптомы, а также системные нарушения, обусловленные транслокацией кишечной микрофлоры во внутреннюю среду организма (лимфатические узлы-мезадениты, мочевыводящая система-пиелонефрит, печень-стеатоз, цирроз, холестаз).
Симптомы дисбактериоза кишечника
- Жидкий стул или запор. При дисбактериозе кишечные стенки всасывают жидкость. Происходит дефицит микроэлементов;
- Вздутие и боли в животе, происходящие из-за сильного газообразования;
- Появление неприятных ощущений, таких как колики, тошнота, изжога, боль;
- Дурной запах изо рта, аллергия и потливость;
- При тяжелой форме дисбактериоза возникает анемия, бессонница, одышка, бледная кожа, сечение волос.
Дисбактериоз делится на 4 степени:
- При первой степени происходят незначительные изменения в кишечнике, которые проявляются небольшим расстройством и со временем оно проходит самостоятельно;
- Из-за небольшого количества ферментов для переработки пищи появляется понос с зеленным оттенком с кислым запахом, а также дополнительно появляются такие симптомы как тошнота и урчание в животе;
- Появляется высокая температура, апатия и слабость, в кале появляются непереваренные частицы пищи;
- Из-за большого количества патогенных микроорганизмов возникает кишечная инфекция в виде сальмонеллы или дизентерии из-за этого происходит авитаминоз, отсутствие аппетита.
Диагностика
Окончательно диагностировать данное заболевание можно только с помощью бактериологического посева или биохимического анализа. В первом случае на питательную среду высеивается кал и в течение недели специалисты получают результат соотношения бактерий. Во втором случае выявляется количество жирных кислот, а также отдел, в котором произошло нарушение и его стадия.
Одно из направлений в диагностике дисбактериоза- исследование содержания в выдыхаемом воздухе различных метаболитов, которые продуцируются с участием кишечных бактерий. Кроме того, в настоящее время внедряются в практику химические методы, позволяющие определять виды бактерий и грибов в разных средах с использованием газовой хроматографии.
Медицинский центр «АРМЕД» располагает собственной сертифицированной лабораторией. Для выявления дисбактериоза пациенту будет необходимо сдать ряд анализов, перечень которых дас ваш лечащий врач.
Лечение дисбактериоза
Терапия больных дисбактериозом включает лечение основного заболевания (на фоне которого развился дисбактериоз) и восстановление нормального состава кишечных бактерий.
В целом лечение состоит из:
- избавления от повышенного бактериального роста в желудочно-кишечном тракте, как правило, это антибактериальные препараты на 10-14 дней;
- восстановления нормальной и полезной микрофлоры в желудочно-кишечном тракте: пробиотики, пребиотики, синбиотики, метабиотики;
- улучшения всасывания полезных бактерий и кишечного пищеварения;
- стимулирования организма к сопротивлению внешним инфекциям.
Назначается диета с учётом типа диспепсии, моторных нарушений и основного заболевания.
Чтобы лечение проходило эффективнее, нужно обязательно соблюдать правила: есть небольшими порциями, но каждые 3 часа, исключить белый хлеб, солёную и жирную пищу. Напитки употреблять после приёма пищи спустя полчаса.
Таким образом, проблема дисбактериоза кишечника остаётся актуальной. Явление дисбактериоза следует рассматривать как вторичное состояние, требующее уточнение причин его развития. Лечебная тактика корректируется с учётом с основного заболевания.
Для предотвращения такого недуга как дисбактериоз к лечению нужно подходить комплексно, а также при возникновении первых признаков обратиться к врачу.
При обнаружении симптомов дисбактериоза записывайтесь на приём гастроэнтеролога в медицинском центре «АРМЕД» по телефону 8 (862) 254-55-55, мы находимся в г. Сочи по адресу: ул. Гагарина д.19 а.
Питание после антибиотиков. Как восстановить организм?
Привет! Ну вот и началась пора вирусов и простуд, больничных и оптовых закупок в аптеках. Я уже тоже успела переболеть, и повезло, что в достаточно легкой форме. Антибиотики в этот раз не пила, но все равно хочу лишний раз напомнить о том, что нужно помогать организму восстановиться не только после самой болезни, но и после приема лекарств.
Чем вредны антибиотики?
Они нарушают микрофлору в желудке.
Дисбактериоз, диарея, колит…Я думаю, с этим все понятно, не буду останавливаться.
Они провоцируют развитие аллергии.
Есть исследования, которые доказывают, что использование антибиотиков в лечение детей увеличивают риск развития аллергии и кожных заболеваний. Я в детстве каждый сезон болела тонзелитом, меня закололи антибиотиками, и аллергический дерматит со мной всю жизнь.
Они развивают невосприимчивость организма к лечению.
Бесконтрольное и бездумное применение антибиотиков будет способствовать только тому, что в будущем, в случае действительно бактериального заболевания привычные антибиотики уже перестанут справляться.
Я не говорю, что нужно спорить с врачом и препятствовать лечению, но очень желательно послушать мнение нескольких специалистов, и точно убедиться, что в конкретном случае заболевание имеет бактериальные очаги, и применение оправдано.
Использовать антибиотики для лечения ОРВИ и гриппа неправильно, в этом случае нужны противовирусные. Но врач может назначить и то, и другое, если есть риск осложнений, которые как раз имеют бактерицидную природу.
Если у вас ОРВИ, то антибиотики не нужны, они могут только снизить иммунитет. Но еще раз напоминаю, что только врач должен принимать решение. Не «назначайте» антибиотики сами себе, даже самые современные и дорогие.
Еще один важный момент. Они бывают не только в лекарствах.
Даже если вы не принимали курс антибиотиков для лечения, но часто и помногу едите мясо, то они все равно могут проникать в организм. Лечение животных на фермах антибиотиками – очень распространенная история. Не важно частный ли это фермер, или большое промышленное производство, хотя во втором варианте вероятность использования антибиотиков выше. Необязательно становиться строгим вегетарианцем – выбирайте проверенных поставщиков и не ешьте много мяса каждый день.
Как восстановить организм после антибиотиков?
Если болезнь и курс был продолжительными, помогать организму нужно сразу в нескольких направлениях:
Восстановить микрофлору.
В этом поможет использование пробиотиков (препаратов с живыми микроорганизмами) и пребиотиков (компонентов пищи или добавки, которые становятся «кормом» для наших родных бактерий). У меня уже была подробная статья про это.
Не запутайтесь, пробиотики – сами бактерии, а пребиотики – это то, чем бактерии «питаются». Принимайте и то, и другое.
Самые популярные пробиотики – Линекс и РиоФлора.
Самые популярные пребиотики – Дюфалак и Хилак Форте.
Огромный выбор зарубежных производителей есть на iherb.
Восстановить моторику кишечника.
Имодиум – один из самых популярных и доступных.
Восстановить пищеварение.
Процессу пищеварения способствуют ферменты. Если вы чувствуете, что желудок с трудом справляется с пищей, то показано применение Пакреатина, Мезим Форте Н, Креон, Пензистал.
Не нужно принимать все и сразу. Почитайте показания, и определите для себя, что больше подходит.
Восстановить общий иммунитет организма.
Больше спите, временно не занимайтесь тяжелыми физическими нагрузками, но обязательно ходите пешком на свежем воздухе.
Печень также страдает после курса антибиотиков, моя прошлая статья была про нее – посмотрите.
Питание после антибиотиков
Рацион может быть таким:
Завтрак. Овсяная каша на молоке/воде – лучший вариант! Можно добавить немного меда, банана или яблок.
Перекус. Любимые фрукты.
Обед. Овощной суп (например, мой томатный) с цельнозерновым тостом, салат с большим количеством листовой зелени, сладким перцем, помидорами и огурцом.
Перекус. Зеленый чай с курагой, черносливом и финиками.
Ужин. Запеченная рыба/индейка/куриная грудка, овощной салат из капусты, моркови, тертого яблока с оливковым маслом.
Хорошо будет добавить сухие отруби – они способствуют «очищению» и нормализации работы кишечника. Вот тут я писала о том, как их правильно выбирать.
В остальном рекомендации стандартны. Старайтесь есть меньше сахара, особенно в чистом рафинированном виде. Полностью исключите спиртное на время, не жарьте на масле и не увлекайтесь специями.
Само собой, пейте больше воды!
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Поделиться ссылкой:
Как восстановить флору кишечника и очистить кишечник после приема антибиотиков
Вот что вам нужно знать, чтобы восстановить здоровье кишечника, помочь своей естественной флоре и выбрать пищевые добавки для здоровья кишечника после антибиотиков.
Стать самым здоровым человеком может показаться непреодолимой задачей, особенно потому, что наши тела могут быть невероятно загадочными и сложными. Но многие люди не знают, что существуют простые, конкретные, изученные способы улучшить свое здоровье, и большинство из них связано с кишечником.
Это потому, что ваше тело полагается на полезные бактерии, которые регулируют пищеварительную систему, поддерживают иммунитет, производство серотонина и многое другое. Вместо того, чтобы выяснять, как избавиться от вредных кишечных бактерий, вы обнаружите, что восстановление кишечной флоры и устранение полезных бактерий важнее.
Содержание
В этой статье наших друзей из Jetson Probiotics исследуются преимущества пробиотиков для смягчения воздействия антибиотиков и другие способы поддержания здоровья кишечника, заботясь о кишечном микробиоме.
☝️ ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ ☝Эта статья предназначена только для информационных целей. Он не предназначен для использования в качестве замены профессиональных медицинских рекомендаций, диагностики или лечения.
Что такое микробиом кишечника?
Зачем кишечнику нужны бактерии (Тед Эд)Микробиом кишечника живет в толстом кишечнике и является домом для самых разнообразных бактерий во всем организме. Это потому, что, в отличие от любой другой части тела, ваш пищеварительный тракт представляет собой открытую экосистему, которая больше подвержена влиянию внешней среды, чем любая другая часть тела.
Что это значит? Что ж, микробиом кишечника может быть сформирован такими вещами, как пол, возраст, географические и социально-экономические условия, диета и состояние здоровья. Это также означает, что микробиом кишечника каждого человека будет разным и на него будут влиять разные факторы.
Хорошие бактерии и здоровье кишечника
Но нам десятилетиями говорили, что все бактерии — зло, поэтому, если вы задаетесь вопросом: «Полезна ли для вас флора?» прямо сейчас, значит, вы не одиноки. Не волнуйтесь, это широко распространенное мнение — миф.Фактически, теперь мы знаем, что бактерии в большинстве своем безвредны, некоторые из них полезны, а лишь некоторые из них вредны.
Чтобы ваш кишечник оставался счастливым и вы были здоровы, это зависит от микробного разнообразия. По сути, должно быть много разных типов микробов, живущих вместе. Когда его нет, это приводит к дисбактериозу, при котором недостаточно разнообразия, и некоторые бактерии могут бесконтрольно расти.
Когда происходит дисбаланс между хорошими и плохими бактериями, микробиом может стать несчастливым, что имеет последствия для пищеварения, воспаления, слизистой оболочки кишечника и даже настроения и здоровья мозга.
Кишечные бактерии и здоровье иммунной системы
Что наиболее важно, захват вредных бактерий может резко повлиять на иммунитет и оставить место для развития инфекций, болезней и хронических заболеваний. Кишечник — это первая линия связи между внешней средой и иммунной системой. Эти двое работают вместе, чтобы взаимно регулировать реакцию нашего организма на вредные патогены.
Но когда иммунная система и кишечник работают вместе, все работает гладко. Это стимулирует рост полезных бактерий, что улучшает иммунитет и работу кишечника.Он вызывает более сильную реакцию на болезнетворные микроорганизмы, в то же время делая организм более устойчивым к естественным кишечным бактериям.
Как антибиотики вредят здоровью кишечника?
Восстановление здоровья кишечника начинается с понимания бактерий в вашем желудочно-кишечном тракте.Антибиотики прописываются почти половине населения Великобритании каждый год от обычных заболеваний и в больницах для лечения и предотвращения серьезных инфекций. Вот наиболее распространенные применения антибиотиков:
| ушные инфекции | Инфекции носовых пазух |
| инфекции грудной клетки | Инфекции горла |
| Инфекции мочевыводящих путей, мочевого пузыря и почек | Кожные и раневые инфекции |
| пневмония |
К сожалению, антибиотики не останавливаются на вредных бактериях и не лечат вирусные инфекции, которые часто почти невозможно отличить от бактериальных.Вместо этого антибиотики убивают и хорошие бактерии, а это плохо, потому что хорошие бактерии часто помогают вашему организму бороться с инфекцией.
Многие люди также испытывают легкие или тяжелые побочные эффекты антибиотиков, особенно если их иммунное здоровье уже подорвано, как у пациентов в больницах. Более того, антибиотики могут оставлять место для чрезвычайно вредных бактерий, таких как кишечная палочка , C.diff и сальмонелла, — инфекции, которые могут быть настолько серьезными, что потребуется госпитализация.
Общие побочные эффекты антибиотиков
- понос
- дрожжевые инфекции
- газ
- рвота
- тошнота
- запор
Несмотря на то, что антибиотики очень эффективны при лечении бактериальных инфекций, важно принять необходимые меры предосторожности, чтобы поддержать микробиом кишечника, потому что сохранение хороших бактерий так же важно, как и уничтожение плохих.
Как лучше всего восстановить здоровье кишечника?
Диета, богатая пребиотическими растительными продуктами, питает микробиом кишечника.Ни для кого не секрет, что здоровье кишечника не является обязательным условием для достижения общего состояния здоровья. Поддерживать уровень полезных бактерий в микробиоме кишечника можно разными способами, включая диету и использование пробиотиков.
Все начинается с диеты. Хорошие бактерии насыщаются клетчаткой и питательными веществами в растительной пище — это пребиотики — и они превращают эти вещества в питательные вещества, которые питают слизистую оболочку кишечника и поддерживают баланс кишечного биома.
С другой стороны, пробиотические добавки содержат миллиарды бактерий из одного или нескольких штаммов бактерий, которые в определенных, изученных дозах приносят пользу вашему здоровью. Вот некоторые из самых известных и хорошо изученных пробиотических бактерий и дрожжей, которые вы найдете в добавках:
| Бифидобактерии | Лактобациллы |
| Лактококк | Сахаромицеты |
☝️ Что говорит Атлас Биомед: ☝️ Ученые-микробиомы из Атласа подчеркивают, что преимущества пробиотиков могут быть временными для некоторых людей и сохраняться только до тех пор, пока они принимают добавки.
Сколько времени нужно, чтобы снова заселить кишечник полезными бактериями?
На этот вопрос нет простого ответа, потому что он зависит от состояния вашего микробиома, качества вашей диеты, принимаемых вами лекарств, уровня физической активности и многого другого. Однако микробиом кишечника очень легко адаптируется и реагирует на положительный образ жизни.
Итак, если вы придерживаетесь диеты с большим количеством цельных продуктов, богатых клетчаткой (ученые называют это пребиотиками) и добавляете пробиотические продукты или добавки, вы можете ускорить восстановление биома кишечника.Кроме того, регулярные упражнения, особенно кардио, связаны с большим разнообразием кишечника.
Как восстановить здоровую флору кишечника
Пробиотики в целом безопасны, и иногда их даже рекомендуется принимать во время курса антибиотиков, за исключением госпитализированных пациентов и людей с ослабленной иммунной системой. После этого они особенно полезны для восстановления микробиома кишечника.
☝️ СОВЕТ Не существует такой вещи, как диета с чистым кишечником — ваш кишечник очищается естественным образом.Тем не менее, вы можете помочь кишечным бактериям сохранить здоровье с помощью пребиотической диеты, богатой растениями.
Какие пробиотики при побочных эффектах антибиотиков?
Пробиотики борются с воздействием антибиотиков на полезные кишечные бактерииОбычно организму требуется время, чтобы сбалансировать микробиом до здорового, разнообразного уровня бактерий. Фактически, исследования показывают, что восстановление после повреждений, нанесенных антибиотиками, занимает около 6 месяцев. И даже тогда организм может даже не вернуться к тому состоянию, в котором он был до антибиотика.
Saccharomyces boulardii , пробиотические дрожжи, особенно хороши для предотвращения и облегчения диареи, связанной с антибиотиками, и диареи путешественников. Это также друг кишечных бактерий, поддерживающий полезные бактерии и предотвращающий воспаления.
Lactobacillus acidophilus , пробиотическая бактерия, наиболее известная тем, что содержится в йогурте, также полезна для кишечника. Исследования показывают, что он помогает лечить и предотвращать инфекции, а также снижает побочные эффекты антибиотиков для пищеварения.
К другим бактериям, которые помогают восстановиться после применения антибиотиков, относятся:
- L. casei
- L. Rhamnosus GG
- L. Plantarum 299v
- B. subtilis
- B. coagulans lactospore
- B. clausii
Каковы долгосрочные последствия нарушения здоровья кишечника?
Не только ваше тело более восприимчиво к инфекциям, ослабленному иммунитету и хроническим воспалениям, но мы также знаем, что несбалансированная микробиота может увеличить риск более поздних хронических заболеваний, таких как болезни сердца, диабет, даже болезни Альцгеймера и Паркинсона.
Микробиом кишечника — это самая разнообразная по бактериальному составу часть вашего тела, и на него влияют то, что вы едите, пьете, уровень вашей активности и лекарства, которые вы принимаете. Это может показаться немного сложным, но для восстановления кишечника не нужно много времени: хорошее питание, регулярные упражнения и некоторая помощь пробиотических бактерий.
Влияние антибиотиков и пищевых компонентов на микробиоту кишечника
Prz Gastroenterol. 2018; 13 (2): 85–92.
Кафедра фармацевтической микробиологии и паразитологии, Вроцлавский медицинский университет, Вроцлав, Польша
Автор, ответственный за переписку. Адрес для корреспонденции: Рут К. Дудек-Вихер, Кафедра фармацевтической микробиологии и паразитологии, Медицинский университет Вроцлава, ул. Боровска 211, 50-556 Вроцлав, Польша. телефон: +48 606 763 589. e-mail: [email protected]Поступила в редакцию 20 ноября 2017 г .; Принято 24 апреля 2018 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0), позволяющая третьим лицам копировать и распространять материал в любых носитель или формат, а также для ремикса, преобразования и развития материала при условии, что оригинальная работа правильно процитирована и указана лицензия.
Эта статья цитируется в других статьях в PMC.Abstract
Микробиота кишечника действует как настоящий орган. Он выполняет важные метаболические функции и регулирует воспалительную реакцию, стимулируя иммунную систему. Нарушение микробного баланса кишечника (дисбактериоз) связывают с серьезными заболеваниями человека и воспалительными заболеваниями. Симбиотические взаимодействия между резидентными микроорганизмами и желудочно-кишечным трактом значительно способствуют поддержанию гомеостаза кишечника.В настоящем обзоре обобщены наши знания о влиянии различных антибиотиков, вызывающих такие долгосрочные последствия, как снижение микробного разнообразия, модуляция соотношения Bacteroidetes / Firmicutes , избыточный рост Clostridium difficile и увеличение распространения условно-патогенных микроорганизмов Salmonella typhimurium , Escherichia spp. И Klebsiella spp. Кроме того, пищевые добавки, такие как эмульгаторы и искусственные подсластители, которые предназначены для снижения риска ожирения и диабета, могут фактически увеличить риск заболеваний из-за микробных изменений.С другой стороны, диетические компоненты, такие как полифенолы, омега-3 кислоты или куркумин, могут положительно влиять на состав микробиоты кишечника.
Ключевые слова: микробиота, антибиотики, диета
Введение
Микробиом человека содержит в десять раз больше клеток, чем остальная часть человеческого тела. В последние годы микробиота кишечника вызывает повышенный интерес в научном сообществе. Бактериальная колонизация кишечника имеет решающее значение для нормального развития многих функциональных аспектов.Нарушения микробиоты кишечника связаны со многими распространенными заболеваниями, такими как аллергии, метаболические заболевания, включая ожирение и диабет, сердечно-сосудистые заболевания [1], воспалительные заболевания кишечника (ВЗК) [2], синдром раздраженного кишечника (СРК) [3], нейродегенеративные заболевания. заболевания [4], муковисцидоз [5] и камни в почках [6]. Большинство кишечных бактерий непатогены и сосуществуют с энтероцитами в симбиотических отношениях. Многие исследования показали, что микробиота кишечника играет фундаментальную роль в поддержании гомеостаза не только в кишечнике, но и во всем организме человека.Высококачественные данные Американского проекта по микробиому человека (HMP) продемонстрировали полезные функции нормальной кишечной флоры на здоровье вплоть до генетического уровня. Например, исследования выявили несколько микробных генов, которые позволяют кишечным бактериям участвовать в интенсивном пищеварительном процессе, происходящем в пищеварительном тракте человека. Хромосомно-кодируемый HMO-родственный кластер генов 1, ответственный за переваривание олигосахаридов грудного молока, является одним из наиболее изученных доказательств вышеупомянутого феномена [7].
Целью данной рукописи является обзор избранных исследований за период 2011–2017 гг., Изучающих изменения в микробиоте кишечника, вызванные антибиотиками и ингредиентами диеты, а также их влияние на здоровье человека. Критерии поиска были основаны на 33 научных статьях, найденных в таких медицинских базах данных, как PubMed, Scopus и Science Direct.
Роль здоровой микробиоты кишечника
Микробиота кишечника относится ко всей популяции микроорганизмов, колонизирующей кишечник.Он включает огромное количество бактерий, грибов, архей, вирусов и простейших. Здоровая микробиота кишечника преимущественно состоит из типов Firmicutes и Bacteroidetes , за которыми следуют Actinobacteria и Verrucomicrobia . Эти типы остаются постоянными, но в каждой части кишечника наблюдается обширное качественное и количественное разнообразие родов.
В микробиоте кишечника встречаются следующие виды: Gemella spp., Megasphaera spp., Pseudomonas spp., Prevotella spp., Streptococcus spp., Rothia spp., Veillonella spp., Clostridium spp., Porphyromonas Eubacterium spp., Ruminococcus spp., Enterobacter spp., Enterococcus spp., Lactobacillus spp., Peptostreptococcus spp., Fusobacteria spp., Lachnacteria spp., Roseburia spp., Butyrivibrio spp., Faecalibacterium spp., Proteobacteria spp. [8].
Обычно эти микробы являются комменсалами или мутуалистами и в основном способствуют метаболизму питательных веществ, в том числе посредством ферментации углеводов. Это приводит к синтезу бутирата, короткоцепочечной жирной кислоты (SCFA), которая является важным источником энергии для колоноцитов. Он известен своими противовоспалительными и противораковыми свойствами. Кишечные микроорганизмы также положительно влияют на липидный обмен.Посредством микробных протеиназ и пептидаз они усиливают метаболизм белков. Более того, они имеют решающее значение для синтеза витамина K, B 12 , биотина и конъюгированных линолевых кислот (CLA). Они превращают желчные кислоты и участвуют в расщеплении различных полифенолов [9, 10].
Способность кишечного микробиома метаболизировать лекарственные препараты оказывает огромное влияние на терапию различных заболеваний. Например, Eggerthella lenta , присутствующее в кишечной микробиоте, снижает доступность дигоксина, превращая его в восстановленный метаболит.Кроме того, микробиом может также индуцировать метаболизм лекарственных средств, таких как противораковое средство, известное как иринотекан, что способствует его токсичности, вызывая диарею, воспаление и анорексию [11]. Физическое присутствие микробиоты в желудочно-кишечном тракте (ЖКТ) предотвращает патогенную колонизацию, конкурируя за места прикрепления или источники питательных веществ, а также за счет производства антимикробных белков (АМП), таких как кателицидины, лектины С-типа и дефенсины [8, 11]. В то же время микробиота играет важную иммуномодулирующую роль.Компоненты и типы клеток иммунной системы, которые участвуют в иммуномодулирующем процессе, включают лимфоидные ткани, ассоциированные с кишечником (GALT) [12].
Кроме того, кишечная микробиота поддерживает целостность кишечного барьера и структуру желудочно-кишечного тракта за счет веществ, продуцируемых Bacteroides thetaiotaomicron, Lactobacillus rhamnosus GG и Akkermansia muciniphila . Барьер кишечника состоит из эпителия, иммунных клеток и кишечных бактерий.Он выполняет защитную функцию от токсинов и болезнетворных микроорганизмов из внешней среды. Он участвует в пищеварении, всасывании питательных веществ, жидкостей и электролитов из пищи и ферментации клетчатки до соединений, которыми питаются кишечные бактерии. Кроме того, кишечный барьер секретирует антитела и участвует в передаче сигналов другим клеткам и органам. Микробиота кишечника способствует структурному развитию слизистой оболочки кишечника и может также модулировать паттерны гликозилирования слизистой оболочки, которые являются местами прикрепления микробов как на клеточной поверхности, так и на субклеточном уровне [8, 13, 14].
В литературе указывается, что кишечные микробы обладают большой способностью метаболизировать 430 загрязнителей окружающей среды. Более того, бактериально-зависимый метаболизм загрязнителей модулирует токсичность для хозяина. И наоборот, загрязнители окружающей среды, как было показано, изменяют состав и метаболическую активность желудочно-кишечных бактерий. Физиологические последствия этих изменений до сих пор не изучены [15]. В настоящее время хорошо известно, что здоровая флора кишечника в значительной степени отвечает за общее состояние здоровья хозяина.Существует множество доказательств того, что изменения состава микробиоты (дисбиоз) и оптимальных функций, вызванные антибиотиками, диетическими ингредиентами и факторами образа жизни, связаны с различными метаболическими и иммунными заболеваниями и увеличением патогенных популяций [1–6, 16–23]. . Однако многие исследования также показали положительный эффект некоторых питательных веществ, которые оказывают сильное влияние на развитие правильно функционирующей микробиоты.
Изменение, связанное с антибиотиками
В настоящее время есть существенные доказательства того, что состав микробиоты кишечника может колебаться в ответ на внешние факторы, такие как антибиотики.
Panda и др. . исследовали фекальную микробиоту 21 пациента после 7-дневного лечения общепринятыми группами антибиотиков: фторхинолонами и β-лактамами. Обе группы значительно снизили микробное разнообразие на 25% и сократили основную филогенетическую микробиоту с 29 до 12 таксонов. Однако на уровне филума эти антибиотики увеличивали соотношение Bacteroidetes / Firmicutes . На уровне видов было обнаружено, что оба типа антибиотиков увеличивают долю нескольких неизвестных таксонов, принадлежащих к роду Bacteroides , грамотрицательной группе бактерий.Кроме того, β-лактамы увеличивали среднюю микробную нагрузку в два раза. Изгнание микроорганизмов, чувствительных к этой группе антибиотиков, дает возможность устойчивым штаммам разрастаться и доминировать в нише [24].
Другое исследование было посвящено долгосрочным последствиям применения антибиотиков для состава, экологии и устойчивости микробиоты кишечника человека. Некоторые антибиотики особенно активны против анаэробных бактерий, которые доминируют и играют важную роль в кишечной микробиоте человека.Одним из примеров является клиндамицин, антибиотик относительно широкого спектра действия, который в первую очередь нацелен на анаэробные бактерии. Клиндамицин продемонстрировал большое негативное влияние на кишечную микробиоту, о чем свидетельствует снижение устойчивости к колонизации патогенами, что приводит к высокому риску псевдомембранозного колита из-за чрезмерного роста Clostridium difficile . К дополнительным эффектам, вызываемым клиндамицином, на кишечную флору относятся гастрит и диарея. Нарушения нормальной функции кишечника могут вызывать такие симптомы, как вздутие живота и боли в кишечнике [25].
Группа исследователей из Мичиганского университета проверила 7 антибиотиков из шести классов на модели животных с целью дифференцированного изменения микробиоты и оценки их устойчивости к колонизации C. difficile . Они наблюдали высокий уровень колонизации C. difficile у мышей, получавших цефоперазон, метронидазол и стрептомицин. Наибольшие различия в уровнях колонизации C. difficile были отмечены у мышей, получавших ампициллин.Ни одна из мышей, получавших ципрофлоксацин, не была колонизирована. Только одна из шести мышей, получавших ванкомицин, была колонизирована, предположительно из-за остаточного ванкомицина, подавляющего рост C. difficile . В целом, эти нарушения антибиотиков обеспечивали разные уровни колонизации C. difficile , что привело к гипотезе о том, что полученные сообщества различались по своему составу [26].
Другое исследование на модели человека дало результаты анализа кишечной микробиоты четырех пациентов.У каждого пациента была собственная исходная микробиота, и, таким образом, был индивидуальный ответ на лечение антибиотиками с колебаниями бактериального разнообразия и состава как для общей, так и для активной микробиоты кишечника. Эти результаты подчеркивают важность исходной микробной структуры в формировании изменений микробиоты во время лечения. В группе пациентов трое получали бактерицидный антибиотик, т.е. моксифлоксацин, цефазолин и ампициллин / сульбактам или амоксициллин, а один — бактериостатической комбинацией пенициллина G и клиндамицина.У пациента, получавшего моксифлоксацин, уменьшилось количество родов Faecalibacterium и Bacteroides . Однако в первые дни лечения другие таксоны, продуцирующие бутират, такие как Roseburia и Lachnospiraceae incertae sedis и потребляющие h3 бактерии Blautia, Collinsella и Bifidobacterium , присутствовали в качестве активной микробиоты, получая источники энергии. для колоноцитов хозяина. В случае пациента, получавшего комбинацию пенициллина G и клиндамицина, было отмечено снижение в активной микробиоте родов Bacteroides и Blautia .У пациента, получавшего цефазолин и ампициллин / сульбактам, наблюдалось значительное увеличение родов Parabacteroides и Bacteroides . Кроме того, использование этих антибиотиков вызывает оппортунистические инфекции, вызываемые Escherichia spp. или Klebsiella spp. Во время лечения четвертого пациента амоксициллином такие роды, как Escherichia или Klebsiella, были почти уничтожены, тогда как таксоны Bacteroides, Blautia и Faecalibacterium оказались менее восприимчивыми к лечению.Обращает на себя внимание тот факт, что этот бактериальный профиль с Bacteroides , Blautia и Faecalibacterium после антибиотического стресса был обнаружен в случае бактерицидных агентов, но не в случае использования бактериостатических противомикробных препаратов [27].
Было установлено, что биохимический профиль изменений, связанных с антибиотиками, также влияет на флору кишечника. Обработанный антибиотиками микробиом высвобождает такие углеводы слизистой оболочки, как фукоза и сиаловая кислота. Повышенный уровень этих веществ способствует распространению условно-патогенных микроорганизмов Salmonella typhimurium и C.difficile в кишечнике. Enterohaemorrhagic Escherichia coli также имеет доступ к фукозе или сиаловой кислоте, высвобождаемой микробиотой кишечника из муцинов [28, 29].
Для исследования взаимосвязи воздействия антибиотиков с нарушениями микробиома на мышиной модели стимуляции роста использовали модель на животных. Мыши получали субтерапевтическую терапию антибиотиками (STAT) и получали диету с высоким содержанием жиров (HFD). Чтобы охарактеризовать изменения микробиоты, вызванные STAT, была проанализирована область V4 гена 16S рРНК, полученная из собранных образцов фекалий.Изучая метаболические функции и функции печени и сравнивая их с контрольной группой мышей, получавших только HFD, было обнаружено, что этот режим способствует инсулинорезистентности и стеатозу печени. Исследование предоставляет новую информацию о взаимосвязи между антибактериальной терапией и метаболизмом, а также патогенезом ожирения [16].
В многочисленных исследованиях были определены взаимодействия между сложными популяциями кишечных микробов и иммунной системой млекопитающих (грызунов) и то, как эта связь нарушается при введении антибиотиков [7, 8, 15, 17, 24, 27].Лечение амоксициллином по существу уничтожает тонкую кишку и снижает плотность анаэробных и аэробных бактерий в толстой кишке. Изменения микробиоты, вызванные амоксициллином, снижают экспрессию генов MHC класса I и II в Lactobacillus spp. в тонком и толстом кишечнике снижают экспрессию АМФ в проксимальном отделе кишечника и увеличивают экспрессию протеазы тучных клеток в дистальном отделе тонкой кишки. Лечение мышей метронидазолом, неомицином и ванкомицином снижает экспрессию других важных иммунных факторов.Это усиливает устойчивую к ванкомицину Enterococcus (VRE) колонизацию кишечного тракта. Изменения микробиоты после лечения антибиотиками также влияют на иммунный ответ на вирусную инфекцию. Неомицин снижает экспрессию двух про-цитокинов, ухудшая реакцию против вирусов гриппа. Другое исследование показало, что лечение антибиотиками усиливает иммунный ответ против вируса опухоли молочной железы мышей (MMTV). Некоторые бактерии обладают способностью модулировать воспалительные процессы.Введение антибиотиков может изменить популяции кишечных комменсальных бактерий и, как следствие, изменить иммунную защиту, что в некоторых случаях приведет к пагубным последствиям для здоровья. Вирусные и бактериальные инфекции или аллергии могут быть вызваны изменениями микробиоты, вызванными антибиотиками [17].
Как описано выше, антибиотики могут оказывать негативное влияние на микробиоту, иммунитет и здоровье. Однако избежать приема антибиотиков часто невозможно, потому что многие инфекции можно победить только с помощью лечения антибиотиками.По этой причине необходимо протестировать новые стратегии, чтобы противодействовать негативному влиянию антибиотиков на микробиоту и иммунные реакции. Чтобы уменьшить неблагоприятные изменения микробиоты кишечника человека, вызванные терапией антибиотиками, в настоящее время широко используются коммерческие пробиотики. В основном такие продукты содержат такие штаммы, как Lactobacillus spp., Bifidobacterium spp. а также пребиотики, такие как фруктоолигосахариды. Также рекомендуется увеличить потребление традиционных ферментированных овощей и молочных продуктов.Трансплантация фекальной микробиоты становится все более эффективной и безопасной у пациентов с рецидивирующей инфекцией Clostridium difficile , воспалительным заболеванием кишечника, ожирением и метаболическим синдромом, вероятно, из-за восстановления нарушенного микробиома [18, 19].
Влияние пищевых ингредиентов
Микробиом человека различается в зависимости от культуры и географического региона. Кроме того, он не является постоянным в течение жизни, а скорее изменяется с возрастом.Диета является особенно важным фактором в определении состава микробиоты кишечника. Таким образом, веганы, вегетарианцы и всеядные имеют разные микробиомы. Общее количество Bacteroides spp., Bifidobacterium spp., Escherichia coli и Enterobacteriaceae spp. были значительно ниже в веганских образцах, чем в контроле. Напротив, всего биоваров E. coli, видов, Klebsiella spp., Enterobacter spp ., Другие Enterobacteriaceae, Enterococcus spp., Lactobacillus spp., Citrobacter spp. и Clostridium spp. были похожи. Общее количество микробов между группами не различалось. Кроме того, испытуемые, соблюдающие веганскую или вегетарианскую диету, показали значительно более низкий pH стула, чем контрольная группа, а pH стула и количество E. coli и Enterobacteriaceae значительно коррелировали во всех подгруппах. Соблюдение строгой веганской или вегетарианской диеты приводит к значительному сдвигу в микробиоте, в то время как общее количество клеток остается неизменным.Диета на основе животных увеличивала количество устойчивых к желчи микроорганизмов, включая Alistipes, Bilophila и Bacteroides , тогда как она снижала уровни Firmicutes , которые метаболизируют полисахариды пищевых растений [1, 20]. Более того, кишечная микробиота всеядных животных производит значительно больше триметиламин-N-оксида (ТМАО) из холина и L-карнитина, присутствующих в яйцах и красном мясе, чем кишечная микробиота веганов или вегетарианцев, благодаря механизму, зависящему от микробиоты.Повышенный уровень ТМАО повышает риск атеросклероза. Таким образом, кишечная микробиота может участвовать в хорошо установленной связи между повышенным потреблением красного мяса или яиц и возникновением сердечно-сосудистых заболеваний [21].
Было продемонстрировано, что даже кратковременное изменение диеты может изменить структуру микробного сообщества. Безглютеновая диета (БГД) является наиболее распространенной специальной диетой во всем мире. Был сделан вывод, что 13 недель GFD оказали значительное влияние на разнообразие микробиома между контрольной и исследуемой группами пациентов, а также наблюдались большие различия в активности путей.Более того, увеличилось количество E. coli и Enterobacteriaceae , включая условно-патогенные микроорганизмы [22].
Западная диета (с высоким содержанием животного жира и белка и низким содержанием клетчатки) приводит к уменьшению общего количества бактерий и полезных Bifidobacterium и Eubacterium , а также к увеличению производства канцерогенных нитрозаминов и воспалений. Средиземноморская диета (с высоким содержанием клетчатки и антиоксидантов и низким содержанием красного мяса) связана с повышенным уровнем фекальных короткоцепочечных жирных кислот (SCFA), Bifidobacteria, Lactobacilli, Eubacteria, Bacteroides и Prevotella [23].
Основным средством защиты кишечника от микробиоты является многослойная структура слизи, покрывающая поверхность кишечника, что позволяет держать подавляющее большинство кишечных бактерий на безопасном расстоянии от эпителиальных клеток, выстилающих кишечник. Таким образом, эмульгаторы, подобные детергентам, которые нарушают взаимодействие слизи с бактериями, могут способствовать развитию заболеваний, связанных с воспалением кишечника. Чассен и его коллеги, используя модель на животных, продемонстрировали, что эмульгаторы карбоксиметилцеллюлоза и полисорбат-80, обычно используемые в обработанной пище, изменяют уровень короткоцепочечных жирных кислот в кале, включая снижение уровня бутирата.Они также изменили уровень желчной кислоты, что влияет на состав микробиоты. В том же исследовании было высказано предположение, что вызванные эмульгатором изменения микробиоты играют роль в развитии воспаления и метаболических изменений, которым способствуют эти пищевые добавки [30].
Также было продемонстрировано, что искусственные подсластители, такие как сахарин, сукралоза, аспартам и ацесульфам К, изменяют микробные сообщества кишечника, что приводит к непереносимости глюкозы как у мышей, так и у людей. Чтобы проверить, приводят ли изменения микробного состава, вызванные потреблением некалорийных искусственных подсластителей (НАС), к непереносимости глюкозы, кишечную микробиоту мышей, получавших НАС, или контрольных мышей переносили на стерильных мышей, которых содержали в асептических условиях. , что делает их желудочно-кишечный тракт полностью стерильным.Результаты показали, что потребление NAS напрямую изменяет микробный состав и метаболизм, что приводит к важным последующим метаболическим эффектам. Та же группа ученых обнаружила корреляцию между потреблением NAS и изменением микробиома кишечника у людей. В своем исследовании 172 случайно выбранных человека из когорты показали микробные изменения кишечника, характеризующиеся увеличением типов энтеробактерий , дельтапротеобактерий и актинобактерий . Что касается воздействия на микробиом животных, было обнаружено, что общее количество анаэробов в микробиоте кишечника крыс значительно снизилось у тех, кто получал сукралозу плюс мальтодекстрин.При самой низкой дозе общее количество анаэробов снизилось примерно на 50% по сравнению с контролем. Bifidobacterium, Lactobacillus и Bacteroides также были значительно снижены при самой низкой дозе. Одновременно повышенная секреция инкретина наблюдалась при сочетании сукралозы с глюкозой. В результате наблюдалось снижение подвижности желудочно-кишечного тракта [31].
Недавно было показано, что два клинически эффективных препарата для лечения диабета — метформин и берберин — оказывают свое действие, модулируя микробиоту кишечника, и могут способствовать благотворному воздействию на хозяина.Было продемонстрировано, что они аналогичным образом изменили общую структуру кишечной микробиоты у крыс. Оба препарата показали обратное действие на структурные изменения микробиоты кишечника, вызванные диетой с высоким содержанием жиров. Разнообразие кишечной микробиоты было значительно сокращено при лечении берберином и метформином. Оба препарата уменьшили 60 из 134 операционных таксономических единиц. Напротив, бактерии, продуцирующие короткоцепочечные жирные кислоты (SCFA) — Allobaculum, Bacteroides, Blautia, Butyricicoccus и Phascolarctobacterium — были заметно увеличены.Хотя и берберин, и метформин увеличивали количество бактерий, продуцирующих SCFA, и снижали микробное разнообразие кишечника, метформин делал это в меньшей степени. Избирательное обогащение SCFA-продуцирующих бактерий и уменьшение разнообразия кишечных микробов с помощью обоих препаратов могут быть общими механизмами улучшения здоровья желудочно-кишечного тракта и могут опосредовать их благотворное влияние на хозяина, особенно при метаболических и сердечно-сосудистых заболеваниях [32].
Куркумин является наиболее активным компонентом измельченного корневища растения Curcuma longa , обладающего противовоспалительными, антиоксидантными и антипролиферативными свойствами.Было обнаружено, что куркумин оказывает существенное влияние на микробиоту кишечника. Куркумин увеличивает количество бактерий у мышей. Кроме того, он предотвращал возрастное снижение альфа-разнообразия, увеличивал относительную численность порядка Lactobacillales и уменьшал численность порядка Coriobacteriales . Поддержание более разнообразной микробной экологии толстой кишки коррелирует с положительным влиянием куркумина на онкогенез [33].
Данные указывают на связь между поступлением омега-3 в кровоток и составом микробиома, что предполагает потенциальное использование добавок омега-3 для улучшения состава микробиома.Грецкие орехи богаты омега-3 жирными кислотами, фитохимическими веществами и антиоксидантами, что делает их уникальными по сравнению с другими продуктами. Потребление грецких орехов было связано с пользой для здоровья, включая снижение риска сердечных заболеваний и рака. Один из потенциальных механизмов, с помощью которого грецкие орехи могут принести пользу для здоровья, — это изменение микробиома кишечника. Исследование Byerleya et al . выявили изменения в микробных сообществах кишечника, которые происходят после включения грецких орехов в рацион крыс.Образцы кишечника были собраны из нисходящей ободочной кишки, ДНК была выделена, и гипервариабельная область V3 – V4 гена 16S рРНК была глубоко секвенирована на Illumina MiSeq для характеристики микробиоты кишечника. Животные, потребляющие грецкие орехи, показали значительно большее видовое разнообразие. Грецкие орехи увеличили численность Firmicutes и уменьшили численность Bacteroidetes . Он также обогатил микробиоту бактериями пробиотического типа, включая Lactobacillus, Ruminococcaceae и Roseburia , при этом значительно уменьшив количество бактерий Bacteroides и Anaerotruncus [34, 35].
Примечательно, что микробиом человека может быть изменен микробными метаболитами неперевариваемых пищевых ингредиентов. В частности, «неперевариваемые» пищевые углеводы, включая полисахариды, олигосахариды, лигнин и связанный с ними растительный материал, являются предпочтительным источником энергии для микробиоты толстой кишки. В настоящее время исследователи изучают влияние микробных метаболитов полифенолов на здоровье эпителиальных клеток слизистой оболочки, кишечника и иммунной системы. Полифенолы известны своей антиоксидантной способностью, а также противовоспалительной и антипролиферативной активностью.В толстой кишке они подвергаются обширной биоконверсии и метаболизму кишечной микробиотой. Они деконъюгированы бактериальными гликозидазами, глюкуронидазами и сульфатазами и далее ферментируются до широкого спектра низкомолекулярных фенольных кислот. Таким образом, микробиота кишечника играет ключевую роль в биодоступности полифенолов и, как было показано, модулирует их укрепляющую здоровье активность посредством преобразования в более активные производные. Соединения, полученные в результате микробного метаболизма проантоцианидинов и полифенолов, обладают противовоспалительными свойствами.Эти микробные метаболиты могут быть среди терапевтических агентов нового поколения для лечения иммуно-воспалительных заболеваний, а также для ослабления воспалительной реакции на бактериальные антигены, что может иметь последствия для хронических воспалительных или аутоиммунных заболеваний, таких как воспалительное заболевание кишечника.
Однако, хотя широкий спектр полезных для здоровья свойств пищевых полифенолов был широко исследован, их влияние на модуляцию экологии кишечника и микробиоту полифенолов с двусторонним взаимодействием все еще плохо изучено.Исследования in vitro на животных и людях свидетельствуют о том, что определенные дозы выбранных полифенолов могут изменять микробный состав кишечника, и хотя некоторые группы бактерий могут быть подавлены, другие могут процветать в доступной нише экосистемы. Фенольные соединения изменяют микробиоту кишечника и, следовательно, изменяют баланс Bacteroides / Firmicutes . Например, мономеры флаван-3-ола, такие как (-) эпикатехин и (+) катехин, могут быть способны влиять на бактериальную популяцию толстого кишечника даже в присутствии других питательных веществ, таких как углеводы и белки.Было обнаружено, что (+) катехин значительно ингибировал рост Clostridium histolyticum и усиливал рост E. coli и членов группы Clostridium coccoides – Eubacterium rectale , в то время как рост Bifidobacterium и Lactobacillus spp. . остались относительно незатронутыми. Также было задокументировано, что богатый проантоцианидином экстракт виноградных косточек, даваемый здоровым взрослым в течение 2 недель, был способен значительно увеличить количество Bifidobacteria .Исследование с участием человека показало, что потребление полифенолов красного вина значительно увеличило количество Enterococcus, Prevotella, Bacteroides, Bifidobacterium, Bacteroides uniformis, Eggerthella lenta и Blautia coccoides – E. rectale при количестве Lactobacillus spp. без изменений [36, 37].
Резюме
Микробы, обитающие в желудочно-кишечном тракте человека, составляют динамическое сообщество, которое меняется на протяжении всей жизни человека, а также под действием диеты и лечебных средств.Краткое изложение положительного и отрицательного воздействия антибиотиков и пищевых добавок на микробиоту и его клиническое значение представлено ниже в разделе.
Таблица I
Сводная информация о влиянии антибиотиков и пищевых соединений на микробиоту кишечника
| Фактор | Изменение | Клиническая значимость |
|---|---|---|
| Фторхинолоны и снижение разнообразия β-лактамов | [24] , уменьшилось количество таксонов, изменилось соотношение Bacteroidetes / Firmicutes , увеличилась средняя микробная нагрузка [24] | Систематическое использование антибиотиков может изменить микробиоту в пользу устойчивых бактериальных штаммов в долгосрочной перспективе [24] |
| Клиндамицин [ 25] | Пониженная резистентность к колонизации патогенами [25] | Высокий риск псевдомембранозного колита, вызванного Разрастание Clostridium difficile , гастритом и диареей, вздутием живота и кишечной болью [25] |
| Моксактифлоксацин, амфазолин, цефазолин , амоксициллин, пенициллин G / клиндамицин [27] | Качественный и кв. антититативные изменения в родах [27] | Повышенный риск оппортунистических инфекций, вызываемых Escherichia spp.или Klebsiella spp. [27] |
| Лечение антибиотиками [17, 28, 29] | Фукоза, сиаловая кислота, выделенная из муцинов [28, 29]. Изменение кишечных комменсальных бактерий вызывает модификацию иммунной защиты [17] | Распространение условно-патогенных микроорганизмов Salmonella typhimurium, C. difficile и E. coli [28, 29]. Продвижение аллергии и вирусных инфекций [17] |
| Холин (яйца), L-карнитин (красное мясо) [21] | Повышенный уровень ТМАО [21] | Повышенный риск атеросклероза [21] |
| Western диета [23] | Уменьшение общего количества бактерий и полезных Bifidobacterium и Eubacterium [23] | Повышенное производство канцерогенных нитрозаминов и воспаление [23] |
| Эмульгаторы: карбоксиметилцеллюлоза и полисорбат-80 [30] | Пониженный уровень бутирата, измененный уровень желчной кислоты [30] | Повышенный риск воспаления и метаболических изменений [30] |
| Искусственные подсластители [31] | Увеличение Enterobacteriaceae, Deltaproteobacteria, и Actinobacteria phylum .Снижение содержания Bifidobacterium, Lactobacillus, и Bacteroides, увеличение секреции инкретина [31] | Непереносимость глюкозы, снижение подвижности и висцеральная гиперчувствительность [31] |
| Метформин и берберин [32] | Структурные изменения микробиоты кишечника значительное снижение разнообразия кишечной микробиоты, увеличение количества бактерий, продуцирующих короткоцепочечные жирные кислоты (SCFA) [32] | Профилактика метаболических заболеваний, эффект против ожирения [32] |
| Куркумин [33] | Увеличение бактериального богатства, увеличилось количество Lactobacillales, и уменьшилось Coriobacteriales [33] | Благоприятное влияние на онкогенез [33] |
| Грецкие орехи, омега-3 жирные кислоты [34, 35] | Большее видовое разнообразие, обогатило микробиоту пробиотиками. тип бактерий [34, 35] | Сниженный риск сердечных заболеваний и рака [34, 35] |
| Полифенолы a и проантоцианидины [36, 37] | Стимуляция роста полезных бактерий и ингибирование патогенных бактерий, оказывающих пребиотикоподобные эффекты, полезные соединения из их микробного метаболизма [36, 37] | Управление иммуновоспалительными заболеваниями, хроническими воспалительными аутоиммунные заболевания, такие как воспалительные заболевания кишечника [36, 37] |
Таким образом, существует множество доказательств того, что микробиота кишечника является основным, все еще недооцененным элементом, который следует рассматривать как важный фактор, влияющий на здоровье человека.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
1. Thomas S, Izard J, Walsh E, et al. Микробиом хозяина регулирует и поддерживает здоровье человека: основа и перспектива для немикробиологов. Cancer Res. 2017; 77: 1783–812. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Матияши М., Мештрович Т., Перич М. и др. Регулирование состава и метаболической активности кишечной микробиоты у пациентов с ВЗК. Int J Mol Sci. 2016; 17: 578.[Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Диструтти Э., Мональди Л., Риччи П. и др. Синдром раздраженного кишечника 2016: глобальный взгляд на роль микробиоты кишечника в синдроме раздраженного кишечника: новые терапевтические стратегии. Мир Дж. Гастроэнтерол. 2016; 22: 2219–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Форсайт П., Кунце В. Голоса изнутри: кишечные микробы и ЦНС. Cell Mol Life Sci. 2013; 70: 55–69. [PubMed] [Google Scholar] 6. Кауфман Д., Келли Дж., Курхан Г. и др. Oxalobacter formigenes может снизить риск образования камней в почках из оксалата кальция.J Am Soc Nephrol. 2008; 19: 1197–203. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Села Д.А., Миллс Д. Уход за нашей микробиотой: молекулярные связи между бифидобактериями и олигосахаридами молока. Trends Microbiol. 2011; 18: 298–307. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Оздал Т., Села Д.А., Сяо Дж. И др. Взаимодействие между полифенолами и микробиотой кишечника и влияние на биодоступность. Питательные вещества. 2016; 8: 78. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Клаассен CD, Юэ Цуй JY.Обзор: механизмы того, как кишечная микробиота влияет на действие лекарств и желчных кислот. Утилизация наркотиков. 2015; 43: 1505–21. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Spanogiannopoulos P, Bess EN, Carmody RN, et al. Фармацевты-микробиологи внутри нас: метагеномный взгляд на метаболизм ксенобиотиков. Nat Rev Microbiol. 2016; 14: 273–87. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Bron PA, Kleerebezem M, Brummer RJ, et al. Могут ли пробиотики модулировать болезнь человека, влияя на барьерную функцию кишечника? Br J Nutr.2017; 117: 93–107. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Marlicz W, Yung DE, Skonieczna-ydecka K, et al. От клинических неопределенностей до точной медицины: растущая роль кишечного барьера и микробиома в функциональных заболеваниях тонкой кишки. Эксперт Рев Гастроэнтерол Гепатол. 2017; 11: 961–78. [PubMed] [Google Scholar] 15. Клаус С.П., Гийу Х., Эллеро-Симатос С. Микробиота кишечника: главный игрок в токсичности загрязнителей окружающей среды? NPJ Biofilms Microbiomes. 2017; 3: 17001. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16.Махана Д., Трент С., Захари Д., Курц З. и др. Нарушение антибиотиками микробиома кишечника мышей усиливает ожирение, инсулинорезистентность и заболевания печени, связанные с диетой с высоким содержанием жиров. Genome Med. 2016; 8: 48. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Leszczyszyn JJ, Radomski M, Leszczyszyn AM. Трансплантация кишечной микробиоты — современный уровень знаний. Reumatologia. 2016; 54: 24–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Циммер Дж., Ланге Б., Фрик Дж. С. и др. Вегетарианская или вегетарианская диета существенно изменяет фекальную микробиоту толстой кишки человека.Eur J Clin Nutr. 2011; 66: 53–6. [PubMed] [Google Scholar] 21. Коэт Р.А., Ван З., Левисон Б.С. и др. Метаболизм L-карнитина, питательного вещества красного мяса, микробиоты кишечника способствует развитию атеросклероза. Nat Med. 2013; 19: 576–85. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Bonder MJ, Tigchelaar EF, Cai X и др. Влияние краткосрочной безглютеновой диеты на микробиом кишечника человека. Genome Med. 2016; 8:45. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Дель Кьерико Ф., Вернокки П., Даллапиккола Б. и др.Средиземноморская диета и здоровье: влияние продуктов питания на микробиоту кишечника и контроль заболеваний. Int J Mol Sci. 2014; 15: 11678–99. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Джернберг С., Лёфмарк С., Эдлунд С. и др. Долгосрочное воздействие антибиотиков на микробиоту кишечника человека. Микробиология. 2010; 156: 3216–23. [PubMed] [Google Scholar] 26. Шуберт А., Синани Х., Schloss PD. Вызванные антибиотиками изменения микробиоты кишечника мышей и последующие эффекты на устойчивость к колонизации против Clostridium difficile.MBio. 2015; 6: e00974–15. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Перес-Кобас А.Е., Артачо А., Кнехт Х. и др. Дифференциальное влияние антибактериальной терапии на структуру и функцию микробиоты кишечника человека. PLoS One. 2013; 8: e80201. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Нг К., Феррейра Дж, Хиггинботтом С. и др. Высвобожденные микробиотой сахара хозяина способствуют распространению кишечных патогенов после приема антибиотиков. Природа. 2013; 502: 96–99. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Хуанг Ю.Л., Чассар С., Хаусманн М. и др.Катаболизм сиаловой кислоты вызывает воспаление кишечника и микробный дисбактериоз у мышей. Nat Commun. 2015; 6: 8141. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Чассен Б., Корен О., Гудрич Дж. К. и др. Пищевые эмульгаторы воздействуют на микробиоту кишечника мышей, вызывая колит и метаболический синдром. Природа. 2016; 519: 404–13. [PubMed] [Google Scholar] 31. Спенсер М., Гупта А., Ван Дам Л. и др. Искусственные подсластители: систематический обзор и учебник для гастроэнтерологов. J Neurogastroenterol Motil. 2016; 22: 168–80.[Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Zhang X, Zhao Y, Xu J, et al. Модуляция кишечной микробиоты берберином и метформином во время лечения ожирения у крыс, вызванного диетой с высоким содержанием жиров. Научный доклад 2015; 5: 14405. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Макфадден Р., Лармонье С., Шехаб К. и др. Роль куркумина в модуляции микробиоты толстой кишки во время профилактики колита и рака толстой кишки. Воспаление кишечника. 2015; 21: 2483–94. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Byerleya LO, Samuelson D, Blanchard E, et al.Изменения в микробном сообществе кишечника после добавления в рацион грецких орехов. J Nutr Biochem. 2017; 48: 94–102. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Сардецка И., Крогульская А., Топоровска-Ковальская Е. Влияние иммуномодулирующих факторов питания на развитие пищевой аллергии у детей. Постэп Дерматол Алергол. 2017; 34: 89–96. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Джейкобс Д.М., Годье Э., ван Дуйнховен Дж. И др. Неперевариваемые пищевые ингредиенты, микробиота толстой кишки и влияние на здоровье кишечника и иммунитет: роль метаболомики.Curr Drug Metab. 2009; 10: 41–54. [PubMed] [Google Scholar] 37. Кардона Ф., Андрес-Лакуевак С., Тюлипани С. и др. Польза полифенолов для микробиоты кишечника и их влияние на здоровье человека. J Nutr Biochem. 2013; 24: 1415–22. [PubMed] [Google Scholar]Влияние антибиотиков и пищевых компонентов на микробиоту кишечника
Prz Gastroenterol. 2018; 13 (2): 85–92.
Кафедра фармацевтической микробиологии и паразитологии, Вроцлавский медицинский университет, Вроцлав, Польша
Автор, ответственный за переписку. Адрес для корреспонденции: Рут К. Дудек-Вихер, Кафедра фармацевтической микробиологии и паразитологии, Медицинский университет Вроцлава, ул. Боровска 211, 50-556 Вроцлав, Польша. телефон: +48 606 763 589. e-mail: [email protected]Поступила в редакцию 20 ноября 2017 г .; Принято 24 апреля 2018 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0), позволяющая третьим лицам копировать и распространять материал в любых носитель или формат, а также для ремикса, преобразования и развития материала при условии, что оригинальная работа правильно процитирована и указана лицензия.
Эта статья цитируется в других статьях в PMC.Abstract
Микробиота кишечника действует как настоящий орган. Он выполняет важные метаболические функции и регулирует воспалительную реакцию, стимулируя иммунную систему. Нарушение микробного баланса кишечника (дисбактериоз) связывают с серьезными заболеваниями человека и воспалительными заболеваниями. Симбиотические взаимодействия между резидентными микроорганизмами и желудочно-кишечным трактом значительно способствуют поддержанию гомеостаза кишечника.В настоящем обзоре обобщены наши знания о влиянии различных антибиотиков, вызывающих такие долгосрочные последствия, как снижение микробного разнообразия, модуляция соотношения Bacteroidetes / Firmicutes , избыточный рост Clostridium difficile и увеличение распространения условно-патогенных микроорганизмов Salmonella typhimurium , Escherichia spp. И Klebsiella spp. Кроме того, пищевые добавки, такие как эмульгаторы и искусственные подсластители, которые предназначены для снижения риска ожирения и диабета, могут фактически увеличить риск заболеваний из-за микробных изменений.С другой стороны, диетические компоненты, такие как полифенолы, омега-3 кислоты или куркумин, могут положительно влиять на состав микробиоты кишечника.
Ключевые слова: микробиота, антибиотики, диета
Введение
Микробиом человека содержит в десять раз больше клеток, чем остальная часть человеческого тела. В последние годы микробиота кишечника вызывает повышенный интерес в научном сообществе. Бактериальная колонизация кишечника имеет решающее значение для нормального развития многих функциональных аспектов.Нарушения микробиоты кишечника связаны со многими распространенными заболеваниями, такими как аллергии, метаболические заболевания, включая ожирение и диабет, сердечно-сосудистые заболевания [1], воспалительные заболевания кишечника (ВЗК) [2], синдром раздраженного кишечника (СРК) [3], нейродегенеративные заболевания. заболевания [4], муковисцидоз [5] и камни в почках [6]. Большинство кишечных бактерий непатогены и сосуществуют с энтероцитами в симбиотических отношениях. Многие исследования показали, что микробиота кишечника играет фундаментальную роль в поддержании гомеостаза не только в кишечнике, но и во всем организме человека.Высококачественные данные Американского проекта по микробиому человека (HMP) продемонстрировали полезные функции нормальной кишечной флоры на здоровье вплоть до генетического уровня. Например, исследования выявили несколько микробных генов, которые позволяют кишечным бактериям участвовать в интенсивном пищеварительном процессе, происходящем в пищеварительном тракте человека. Хромосомно-кодируемый HMO-родственный кластер генов 1, ответственный за переваривание олигосахаридов грудного молока, является одним из наиболее изученных доказательств вышеупомянутого феномена [7].
Целью данной рукописи является обзор избранных исследований за период 2011–2017 гг., Изучающих изменения в микробиоте кишечника, вызванные антибиотиками и ингредиентами диеты, а также их влияние на здоровье человека. Критерии поиска были основаны на 33 научных статьях, найденных в таких медицинских базах данных, как PubMed, Scopus и Science Direct.
Роль здоровой микробиоты кишечника
Микробиота кишечника относится ко всей популяции микроорганизмов, колонизирующей кишечник.Он включает огромное количество бактерий, грибов, архей, вирусов и простейших. Здоровая микробиота кишечника преимущественно состоит из типов Firmicutes и Bacteroidetes , за которыми следуют Actinobacteria и Verrucomicrobia . Эти типы остаются постоянными, но в каждой части кишечника наблюдается обширное качественное и количественное разнообразие родов.
В микробиоте кишечника встречаются следующие виды: Gemella spp., Megasphaera spp., Pseudomonas spp., Prevotella spp., Streptococcus spp., Rothia spp., Veillonella spp., Clostridium spp., Porphyromonas Eubacterium spp., Ruminococcus spp., Enterobacter spp., Enterococcus spp., Lactobacillus spp., Peptostreptococcus spp., Fusobacteria spp., Lachnacteria spp., Roseburia spp., Butyrivibrio spp., Faecalibacterium spp., Proteobacteria spp. [8].
Обычно эти микробы являются комменсалами или мутуалистами и в основном способствуют метаболизму питательных веществ, в том числе посредством ферментации углеводов. Это приводит к синтезу бутирата, короткоцепочечной жирной кислоты (SCFA), которая является важным источником энергии для колоноцитов. Он известен своими противовоспалительными и противораковыми свойствами. Кишечные микроорганизмы также положительно влияют на липидный обмен.Посредством микробных протеиназ и пептидаз они усиливают метаболизм белков. Более того, они имеют решающее значение для синтеза витамина K, B 12 , биотина и конъюгированных линолевых кислот (CLA). Они превращают желчные кислоты и участвуют в расщеплении различных полифенолов [9, 10].
Способность кишечного микробиома метаболизировать лекарственные препараты оказывает огромное влияние на терапию различных заболеваний. Например, Eggerthella lenta , присутствующее в кишечной микробиоте, снижает доступность дигоксина, превращая его в восстановленный метаболит.Кроме того, микробиом может также индуцировать метаболизм лекарственных средств, таких как противораковое средство, известное как иринотекан, что способствует его токсичности, вызывая диарею, воспаление и анорексию [11]. Физическое присутствие микробиоты в желудочно-кишечном тракте (ЖКТ) предотвращает патогенную колонизацию, конкурируя за места прикрепления или источники питательных веществ, а также за счет производства антимикробных белков (АМП), таких как кателицидины, лектины С-типа и дефенсины [8, 11]. В то же время микробиота играет важную иммуномодулирующую роль.Компоненты и типы клеток иммунной системы, которые участвуют в иммуномодулирующем процессе, включают лимфоидные ткани, ассоциированные с кишечником (GALT) [12].
Кроме того, кишечная микробиота поддерживает целостность кишечного барьера и структуру желудочно-кишечного тракта за счет веществ, продуцируемых Bacteroides thetaiotaomicron, Lactobacillus rhamnosus GG и Akkermansia muciniphila . Барьер кишечника состоит из эпителия, иммунных клеток и кишечных бактерий.Он выполняет защитную функцию от токсинов и болезнетворных микроорганизмов из внешней среды. Он участвует в пищеварении, всасывании питательных веществ, жидкостей и электролитов из пищи и ферментации клетчатки до соединений, которыми питаются кишечные бактерии. Кроме того, кишечный барьер секретирует антитела и участвует в передаче сигналов другим клеткам и органам. Микробиота кишечника способствует структурному развитию слизистой оболочки кишечника и может также модулировать паттерны гликозилирования слизистой оболочки, которые являются местами прикрепления микробов как на клеточной поверхности, так и на субклеточном уровне [8, 13, 14].
В литературе указывается, что кишечные микробы обладают большой способностью метаболизировать 430 загрязнителей окружающей среды. Более того, бактериально-зависимый метаболизм загрязнителей модулирует токсичность для хозяина. И наоборот, загрязнители окружающей среды, как было показано, изменяют состав и метаболическую активность желудочно-кишечных бактерий. Физиологические последствия этих изменений до сих пор не изучены [15]. В настоящее время хорошо известно, что здоровая флора кишечника в значительной степени отвечает за общее состояние здоровья хозяина.Существует множество доказательств того, что изменения состава микробиоты (дисбиоз) и оптимальных функций, вызванные антибиотиками, диетическими ингредиентами и факторами образа жизни, связаны с различными метаболическими и иммунными заболеваниями и увеличением патогенных популяций [1–6, 16–23]. . Однако многие исследования также показали положительный эффект некоторых питательных веществ, которые оказывают сильное влияние на развитие правильно функционирующей микробиоты.
Изменение, связанное с антибиотиками
В настоящее время есть существенные доказательства того, что состав микробиоты кишечника может колебаться в ответ на внешние факторы, такие как антибиотики.
Panda и др. . исследовали фекальную микробиоту 21 пациента после 7-дневного лечения общепринятыми группами антибиотиков: фторхинолонами и β-лактамами. Обе группы значительно снизили микробное разнообразие на 25% и сократили основную филогенетическую микробиоту с 29 до 12 таксонов. Однако на уровне филума эти антибиотики увеличивали соотношение Bacteroidetes / Firmicutes . На уровне видов было обнаружено, что оба типа антибиотиков увеличивают долю нескольких неизвестных таксонов, принадлежащих к роду Bacteroides , грамотрицательной группе бактерий.Кроме того, β-лактамы увеличивали среднюю микробную нагрузку в два раза. Изгнание микроорганизмов, чувствительных к этой группе антибиотиков, дает возможность устойчивым штаммам разрастаться и доминировать в нише [24].
Другое исследование было посвящено долгосрочным последствиям применения антибиотиков для состава, экологии и устойчивости микробиоты кишечника человека. Некоторые антибиотики особенно активны против анаэробных бактерий, которые доминируют и играют важную роль в кишечной микробиоте человека.Одним из примеров является клиндамицин, антибиотик относительно широкого спектра действия, который в первую очередь нацелен на анаэробные бактерии. Клиндамицин продемонстрировал большое негативное влияние на кишечную микробиоту, о чем свидетельствует снижение устойчивости к колонизации патогенами, что приводит к высокому риску псевдомембранозного колита из-за чрезмерного роста Clostridium difficile . К дополнительным эффектам, вызываемым клиндамицином, на кишечную флору относятся гастрит и диарея. Нарушения нормальной функции кишечника могут вызывать такие симптомы, как вздутие живота и боли в кишечнике [25].
Группа исследователей из Мичиганского университета проверила 7 антибиотиков из шести классов на модели животных с целью дифференцированного изменения микробиоты и оценки их устойчивости к колонизации C. difficile . Они наблюдали высокий уровень колонизации C. difficile у мышей, получавших цефоперазон, метронидазол и стрептомицин. Наибольшие различия в уровнях колонизации C. difficile были отмечены у мышей, получавших ампициллин.Ни одна из мышей, получавших ципрофлоксацин, не была колонизирована. Только одна из шести мышей, получавших ванкомицин, была колонизирована, предположительно из-за остаточного ванкомицина, подавляющего рост C. difficile . В целом, эти нарушения антибиотиков обеспечивали разные уровни колонизации C. difficile , что привело к гипотезе о том, что полученные сообщества различались по своему составу [26].
Другое исследование на модели человека дало результаты анализа кишечной микробиоты четырех пациентов.У каждого пациента была собственная исходная микробиота, и, таким образом, был индивидуальный ответ на лечение антибиотиками с колебаниями бактериального разнообразия и состава как для общей, так и для активной микробиоты кишечника. Эти результаты подчеркивают важность исходной микробной структуры в формировании изменений микробиоты во время лечения. В группе пациентов трое получали бактерицидный антибиотик, т.е. моксифлоксацин, цефазолин и ампициллин / сульбактам или амоксициллин, а один — бактериостатической комбинацией пенициллина G и клиндамицина.У пациента, получавшего моксифлоксацин, уменьшилось количество родов Faecalibacterium и Bacteroides . Однако в первые дни лечения другие таксоны, продуцирующие бутират, такие как Roseburia и Lachnospiraceae incertae sedis и потребляющие h3 бактерии Blautia, Collinsella и Bifidobacterium , присутствовали в качестве активной микробиоты, получая источники энергии. для колоноцитов хозяина. В случае пациента, получавшего комбинацию пенициллина G и клиндамицина, было отмечено снижение в активной микробиоте родов Bacteroides и Blautia .У пациента, получавшего цефазолин и ампициллин / сульбактам, наблюдалось значительное увеличение родов Parabacteroides и Bacteroides . Кроме того, использование этих антибиотиков вызывает оппортунистические инфекции, вызываемые Escherichia spp. или Klebsiella spp. Во время лечения четвертого пациента амоксициллином такие роды, как Escherichia или Klebsiella, были почти уничтожены, тогда как таксоны Bacteroides, Blautia и Faecalibacterium оказались менее восприимчивыми к лечению.Обращает на себя внимание тот факт, что этот бактериальный профиль с Bacteroides , Blautia и Faecalibacterium после антибиотического стресса был обнаружен в случае бактерицидных агентов, но не в случае использования бактериостатических противомикробных препаратов [27].
Было установлено, что биохимический профиль изменений, связанных с антибиотиками, также влияет на флору кишечника. Обработанный антибиотиками микробиом высвобождает такие углеводы слизистой оболочки, как фукоза и сиаловая кислота. Повышенный уровень этих веществ способствует распространению условно-патогенных микроорганизмов Salmonella typhimurium и C.difficile в кишечнике. Enterohaemorrhagic Escherichia coli также имеет доступ к фукозе или сиаловой кислоте, высвобождаемой микробиотой кишечника из муцинов [28, 29].
Для исследования взаимосвязи воздействия антибиотиков с нарушениями микробиома на мышиной модели стимуляции роста использовали модель на животных. Мыши получали субтерапевтическую терапию антибиотиками (STAT) и получали диету с высоким содержанием жиров (HFD). Чтобы охарактеризовать изменения микробиоты, вызванные STAT, была проанализирована область V4 гена 16S рРНК, полученная из собранных образцов фекалий.Изучая метаболические функции и функции печени и сравнивая их с контрольной группой мышей, получавших только HFD, было обнаружено, что этот режим способствует инсулинорезистентности и стеатозу печени. Исследование предоставляет новую информацию о взаимосвязи между антибактериальной терапией и метаболизмом, а также патогенезом ожирения [16].
В многочисленных исследованиях были определены взаимодействия между сложными популяциями кишечных микробов и иммунной системой млекопитающих (грызунов) и то, как эта связь нарушается при введении антибиотиков [7, 8, 15, 17, 24, 27].Лечение амоксициллином по существу уничтожает тонкую кишку и снижает плотность анаэробных и аэробных бактерий в толстой кишке. Изменения микробиоты, вызванные амоксициллином, снижают экспрессию генов MHC класса I и II в Lactobacillus spp. в тонком и толстом кишечнике снижают экспрессию АМФ в проксимальном отделе кишечника и увеличивают экспрессию протеазы тучных клеток в дистальном отделе тонкой кишки. Лечение мышей метронидазолом, неомицином и ванкомицином снижает экспрессию других важных иммунных факторов.Это усиливает устойчивую к ванкомицину Enterococcus (VRE) колонизацию кишечного тракта. Изменения микробиоты после лечения антибиотиками также влияют на иммунный ответ на вирусную инфекцию. Неомицин снижает экспрессию двух про-цитокинов, ухудшая реакцию против вирусов гриппа. Другое исследование показало, что лечение антибиотиками усиливает иммунный ответ против вируса опухоли молочной железы мышей (MMTV). Некоторые бактерии обладают способностью модулировать воспалительные процессы.Введение антибиотиков может изменить популяции кишечных комменсальных бактерий и, как следствие, изменить иммунную защиту, что в некоторых случаях приведет к пагубным последствиям для здоровья. Вирусные и бактериальные инфекции или аллергии могут быть вызваны изменениями микробиоты, вызванными антибиотиками [17].
Как описано выше, антибиотики могут оказывать негативное влияние на микробиоту, иммунитет и здоровье. Однако избежать приема антибиотиков часто невозможно, потому что многие инфекции можно победить только с помощью лечения антибиотиками.По этой причине необходимо протестировать новые стратегии, чтобы противодействовать негативному влиянию антибиотиков на микробиоту и иммунные реакции. Чтобы уменьшить неблагоприятные изменения микробиоты кишечника человека, вызванные терапией антибиотиками, в настоящее время широко используются коммерческие пробиотики. В основном такие продукты содержат такие штаммы, как Lactobacillus spp., Bifidobacterium spp. а также пребиотики, такие как фруктоолигосахариды. Также рекомендуется увеличить потребление традиционных ферментированных овощей и молочных продуктов.Трансплантация фекальной микробиоты становится все более эффективной и безопасной у пациентов с рецидивирующей инфекцией Clostridium difficile , воспалительным заболеванием кишечника, ожирением и метаболическим синдромом, вероятно, из-за восстановления нарушенного микробиома [18, 19].
Влияние пищевых ингредиентов
Микробиом человека различается в зависимости от культуры и географического региона. Кроме того, он не является постоянным в течение жизни, а скорее изменяется с возрастом.Диета является особенно важным фактором в определении состава микробиоты кишечника. Таким образом, веганы, вегетарианцы и всеядные имеют разные микробиомы. Общее количество Bacteroides spp., Bifidobacterium spp., Escherichia coli и Enterobacteriaceae spp. были значительно ниже в веганских образцах, чем в контроле. Напротив, всего биоваров E. coli, видов, Klebsiella spp., Enterobacter spp ., Другие Enterobacteriaceae, Enterococcus spp., Lactobacillus spp., Citrobacter spp. и Clostridium spp. были похожи. Общее количество микробов между группами не различалось. Кроме того, испытуемые, соблюдающие веганскую или вегетарианскую диету, показали значительно более низкий pH стула, чем контрольная группа, а pH стула и количество E. coli и Enterobacteriaceae значительно коррелировали во всех подгруппах. Соблюдение строгой веганской или вегетарианской диеты приводит к значительному сдвигу в микробиоте, в то время как общее количество клеток остается неизменным.Диета на основе животных увеличивала количество устойчивых к желчи микроорганизмов, включая Alistipes, Bilophila и Bacteroides , тогда как она снижала уровни Firmicutes , которые метаболизируют полисахариды пищевых растений [1, 20]. Более того, кишечная микробиота всеядных животных производит значительно больше триметиламин-N-оксида (ТМАО) из холина и L-карнитина, присутствующих в яйцах и красном мясе, чем кишечная микробиота веганов или вегетарианцев, благодаря механизму, зависящему от микробиоты.Повышенный уровень ТМАО повышает риск атеросклероза. Таким образом, кишечная микробиота может участвовать в хорошо установленной связи между повышенным потреблением красного мяса или яиц и возникновением сердечно-сосудистых заболеваний [21].
Было продемонстрировано, что даже кратковременное изменение диеты может изменить структуру микробного сообщества. Безглютеновая диета (БГД) является наиболее распространенной специальной диетой во всем мире. Был сделан вывод, что 13 недель GFD оказали значительное влияние на разнообразие микробиома между контрольной и исследуемой группами пациентов, а также наблюдались большие различия в активности путей.Более того, увеличилось количество E. coli и Enterobacteriaceae , включая условно-патогенные микроорганизмы [22].
Западная диета (с высоким содержанием животного жира и белка и низким содержанием клетчатки) приводит к уменьшению общего количества бактерий и полезных Bifidobacterium и Eubacterium , а также к увеличению производства канцерогенных нитрозаминов и воспалений. Средиземноморская диета (с высоким содержанием клетчатки и антиоксидантов и низким содержанием красного мяса) связана с повышенным уровнем фекальных короткоцепочечных жирных кислот (SCFA), Bifidobacteria, Lactobacilli, Eubacteria, Bacteroides и Prevotella [23].
Основным средством защиты кишечника от микробиоты является многослойная структура слизи, покрывающая поверхность кишечника, что позволяет держать подавляющее большинство кишечных бактерий на безопасном расстоянии от эпителиальных клеток, выстилающих кишечник. Таким образом, эмульгаторы, подобные детергентам, которые нарушают взаимодействие слизи с бактериями, могут способствовать развитию заболеваний, связанных с воспалением кишечника. Чассен и его коллеги, используя модель на животных, продемонстрировали, что эмульгаторы карбоксиметилцеллюлоза и полисорбат-80, обычно используемые в обработанной пище, изменяют уровень короткоцепочечных жирных кислот в кале, включая снижение уровня бутирата.Они также изменили уровень желчной кислоты, что влияет на состав микробиоты. В том же исследовании было высказано предположение, что вызванные эмульгатором изменения микробиоты играют роль в развитии воспаления и метаболических изменений, которым способствуют эти пищевые добавки [30].
Также было продемонстрировано, что искусственные подсластители, такие как сахарин, сукралоза, аспартам и ацесульфам К, изменяют микробные сообщества кишечника, что приводит к непереносимости глюкозы как у мышей, так и у людей. Чтобы проверить, приводят ли изменения микробного состава, вызванные потреблением некалорийных искусственных подсластителей (НАС), к непереносимости глюкозы, кишечную микробиоту мышей, получавших НАС, или контрольных мышей переносили на стерильных мышей, которых содержали в асептических условиях. , что делает их желудочно-кишечный тракт полностью стерильным.Результаты показали, что потребление NAS напрямую изменяет микробный состав и метаболизм, что приводит к важным последующим метаболическим эффектам. Та же группа ученых обнаружила корреляцию между потреблением NAS и изменением микробиома кишечника у людей. В своем исследовании 172 случайно выбранных человека из когорты показали микробные изменения кишечника, характеризующиеся увеличением типов энтеробактерий , дельтапротеобактерий и актинобактерий . Что касается воздействия на микробиом животных, было обнаружено, что общее количество анаэробов в микробиоте кишечника крыс значительно снизилось у тех, кто получал сукралозу плюс мальтодекстрин.При самой низкой дозе общее количество анаэробов снизилось примерно на 50% по сравнению с контролем. Bifidobacterium, Lactobacillus и Bacteroides также были значительно снижены при самой низкой дозе. Одновременно повышенная секреция инкретина наблюдалась при сочетании сукралозы с глюкозой. В результате наблюдалось снижение подвижности желудочно-кишечного тракта [31].
Недавно было показано, что два клинически эффективных препарата для лечения диабета — метформин и берберин — оказывают свое действие, модулируя микробиоту кишечника, и могут способствовать благотворному воздействию на хозяина.Было продемонстрировано, что они аналогичным образом изменили общую структуру кишечной микробиоты у крыс. Оба препарата показали обратное действие на структурные изменения микробиоты кишечника, вызванные диетой с высоким содержанием жиров. Разнообразие кишечной микробиоты было значительно сокращено при лечении берберином и метформином. Оба препарата уменьшили 60 из 134 операционных таксономических единиц. Напротив, бактерии, продуцирующие короткоцепочечные жирные кислоты (SCFA) — Allobaculum, Bacteroides, Blautia, Butyricicoccus и Phascolarctobacterium — были заметно увеличены.Хотя и берберин, и метформин увеличивали количество бактерий, продуцирующих SCFA, и снижали микробное разнообразие кишечника, метформин делал это в меньшей степени. Избирательное обогащение SCFA-продуцирующих бактерий и уменьшение разнообразия кишечных микробов с помощью обоих препаратов могут быть общими механизмами улучшения здоровья желудочно-кишечного тракта и могут опосредовать их благотворное влияние на хозяина, особенно при метаболических и сердечно-сосудистых заболеваниях [32].
Куркумин является наиболее активным компонентом измельченного корневища растения Curcuma longa , обладающего противовоспалительными, антиоксидантными и антипролиферативными свойствами.Было обнаружено, что куркумин оказывает существенное влияние на микробиоту кишечника. Куркумин увеличивает количество бактерий у мышей. Кроме того, он предотвращал возрастное снижение альфа-разнообразия, увеличивал относительную численность порядка Lactobacillales и уменьшал численность порядка Coriobacteriales . Поддержание более разнообразной микробной экологии толстой кишки коррелирует с положительным влиянием куркумина на онкогенез [33].
Данные указывают на связь между поступлением омега-3 в кровоток и составом микробиома, что предполагает потенциальное использование добавок омега-3 для улучшения состава микробиома.Грецкие орехи богаты омега-3 жирными кислотами, фитохимическими веществами и антиоксидантами, что делает их уникальными по сравнению с другими продуктами. Потребление грецких орехов было связано с пользой для здоровья, включая снижение риска сердечных заболеваний и рака. Один из потенциальных механизмов, с помощью которого грецкие орехи могут принести пользу для здоровья, — это изменение микробиома кишечника. Исследование Byerleya et al . выявили изменения в микробных сообществах кишечника, которые происходят после включения грецких орехов в рацион крыс.Образцы кишечника были собраны из нисходящей ободочной кишки, ДНК была выделена, и гипервариабельная область V3 – V4 гена 16S рРНК была глубоко секвенирована на Illumina MiSeq для характеристики микробиоты кишечника. Животные, потребляющие грецкие орехи, показали значительно большее видовое разнообразие. Грецкие орехи увеличили численность Firmicutes и уменьшили численность Bacteroidetes . Он также обогатил микробиоту бактериями пробиотического типа, включая Lactobacillus, Ruminococcaceae и Roseburia , при этом значительно уменьшив количество бактерий Bacteroides и Anaerotruncus [34, 35].
Примечательно, что микробиом человека может быть изменен микробными метаболитами неперевариваемых пищевых ингредиентов. В частности, «неперевариваемые» пищевые углеводы, включая полисахариды, олигосахариды, лигнин и связанный с ними растительный материал, являются предпочтительным источником энергии для микробиоты толстой кишки. В настоящее время исследователи изучают влияние микробных метаболитов полифенолов на здоровье эпителиальных клеток слизистой оболочки, кишечника и иммунной системы. Полифенолы известны своей антиоксидантной способностью, а также противовоспалительной и антипролиферативной активностью.В толстой кишке они подвергаются обширной биоконверсии и метаболизму кишечной микробиотой. Они деконъюгированы бактериальными гликозидазами, глюкуронидазами и сульфатазами и далее ферментируются до широкого спектра низкомолекулярных фенольных кислот. Таким образом, микробиота кишечника играет ключевую роль в биодоступности полифенолов и, как было показано, модулирует их укрепляющую здоровье активность посредством преобразования в более активные производные. Соединения, полученные в результате микробного метаболизма проантоцианидинов и полифенолов, обладают противовоспалительными свойствами.Эти микробные метаболиты могут быть среди терапевтических агентов нового поколения для лечения иммуно-воспалительных заболеваний, а также для ослабления воспалительной реакции на бактериальные антигены, что может иметь последствия для хронических воспалительных или аутоиммунных заболеваний, таких как воспалительное заболевание кишечника.
Однако, хотя широкий спектр полезных для здоровья свойств пищевых полифенолов был широко исследован, их влияние на модуляцию экологии кишечника и микробиоту полифенолов с двусторонним взаимодействием все еще плохо изучено.Исследования in vitro на животных и людях свидетельствуют о том, что определенные дозы выбранных полифенолов могут изменять микробный состав кишечника, и хотя некоторые группы бактерий могут быть подавлены, другие могут процветать в доступной нише экосистемы. Фенольные соединения изменяют микробиоту кишечника и, следовательно, изменяют баланс Bacteroides / Firmicutes . Например, мономеры флаван-3-ола, такие как (-) эпикатехин и (+) катехин, могут быть способны влиять на бактериальную популяцию толстого кишечника даже в присутствии других питательных веществ, таких как углеводы и белки.Было обнаружено, что (+) катехин значительно ингибировал рост Clostridium histolyticum и усиливал рост E. coli и членов группы Clostridium coccoides – Eubacterium rectale , в то время как рост Bifidobacterium и Lactobacillus spp. . остались относительно незатронутыми. Также было задокументировано, что богатый проантоцианидином экстракт виноградных косточек, даваемый здоровым взрослым в течение 2 недель, был способен значительно увеличить количество Bifidobacteria .Исследование с участием человека показало, что потребление полифенолов красного вина значительно увеличило количество Enterococcus, Prevotella, Bacteroides, Bifidobacterium, Bacteroides uniformis, Eggerthella lenta и Blautia coccoides – E. rectale при количестве Lactobacillus spp. без изменений [36, 37].
Резюме
Микробы, обитающие в желудочно-кишечном тракте человека, составляют динамическое сообщество, которое меняется на протяжении всей жизни человека, а также под действием диеты и лечебных средств.Краткое изложение положительного и отрицательного воздействия антибиотиков и пищевых добавок на микробиоту и его клиническое значение представлено ниже в разделе.
Таблица I
Сводная информация о влиянии антибиотиков и пищевых соединений на микробиоту кишечника
| Фактор | Изменение | Клиническая значимость |
|---|---|---|
| Фторхинолоны и снижение разнообразия β-лактамов | [24] , уменьшилось количество таксонов, изменилось соотношение Bacteroidetes / Firmicutes , увеличилась средняя микробная нагрузка [24] | Систематическое использование антибиотиков может изменить микробиоту в пользу устойчивых бактериальных штаммов в долгосрочной перспективе [24] |
| Клиндамицин [ 25] | Пониженная резистентность к колонизации патогенами [25] | Высокий риск псевдомембранозного колита, вызванного Разрастание Clostridium difficile , гастритом и диареей, вздутием живота и кишечной болью [25] |
| Моксактифлоксацин, амфазолин, цефазолин , амоксициллин, пенициллин G / клиндамицин [27] | Качественный и кв. антититативные изменения в родах [27] | Повышенный риск оппортунистических инфекций, вызываемых Escherichia spp.или Klebsiella spp. [27] |
| Лечение антибиотиками [17, 28, 29] | Фукоза, сиаловая кислота, выделенная из муцинов [28, 29]. Изменение кишечных комменсальных бактерий вызывает модификацию иммунной защиты [17] | Распространение условно-патогенных микроорганизмов Salmonella typhimurium, C. difficile и E. coli [28, 29]. Продвижение аллергии и вирусных инфекций [17] |
| Холин (яйца), L-карнитин (красное мясо) [21] | Повышенный уровень ТМАО [21] | Повышенный риск атеросклероза [21] |
| Western диета [23] | Уменьшение общего количества бактерий и полезных Bifidobacterium и Eubacterium [23] | Повышенное производство канцерогенных нитрозаминов и воспаление [23] |
| Эмульгаторы: карбоксиметилцеллюлоза и полисорбат-80 [30] | Пониженный уровень бутирата, измененный уровень желчной кислоты [30] | Повышенный риск воспаления и метаболических изменений [30] |
| Искусственные подсластители [31] | Увеличение Enterobacteriaceae, Deltaproteobacteria, и Actinobacteria phylum .Снижение содержания Bifidobacterium, Lactobacillus, и Bacteroides, увеличение секреции инкретина [31] | Непереносимость глюкозы, снижение подвижности и висцеральная гиперчувствительность [31] |
| Метформин и берберин [32] | Структурные изменения микробиоты кишечника значительное снижение разнообразия кишечной микробиоты, увеличение количества бактерий, продуцирующих короткоцепочечные жирные кислоты (SCFA) [32] | Профилактика метаболических заболеваний, эффект против ожирения [32] |
| Куркумин [33] | Увеличение бактериального богатства, увеличилось количество Lactobacillales, и уменьшилось Coriobacteriales [33] | Благоприятное влияние на онкогенез [33] |
| Грецкие орехи, омега-3 жирные кислоты [34, 35] | Большее видовое разнообразие, обогатило микробиоту пробиотиками. тип бактерий [34, 35] | Сниженный риск сердечных заболеваний и рака [34, 35] |
| Полифенолы a и проантоцианидины [36, 37] | Стимуляция роста полезных бактерий и ингибирование патогенных бактерий, оказывающих пребиотикоподобные эффекты, полезные соединения из их микробного метаболизма [36, 37] | Управление иммуновоспалительными заболеваниями, хроническими воспалительными аутоиммунные заболевания, такие как воспалительные заболевания кишечника [36, 37] |
Таким образом, существует множество доказательств того, что микробиота кишечника является основным, все еще недооцененным элементом, который следует рассматривать как важный фактор, влияющий на здоровье человека.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
1. Thomas S, Izard J, Walsh E, et al. Микробиом хозяина регулирует и поддерживает здоровье человека: основа и перспектива для немикробиологов. Cancer Res. 2017; 77: 1783–812. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Матияши М., Мештрович Т., Перич М. и др. Регулирование состава и метаболической активности кишечной микробиоты у пациентов с ВЗК. Int J Mol Sci. 2016; 17: 578.[Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Диструтти Э., Мональди Л., Риччи П. и др. Синдром раздраженного кишечника 2016: глобальный взгляд на роль микробиоты кишечника в синдроме раздраженного кишечника: новые терапевтические стратегии. Мир Дж. Гастроэнтерол. 2016; 22: 2219–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Форсайт П., Кунце В. Голоса изнутри: кишечные микробы и ЦНС. Cell Mol Life Sci. 2013; 70: 55–69. [PubMed] [Google Scholar] 6. Кауфман Д., Келли Дж., Курхан Г. и др. Oxalobacter formigenes может снизить риск образования камней в почках из оксалата кальция.J Am Soc Nephrol. 2008; 19: 1197–203. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Села Д.А., Миллс Д. Уход за нашей микробиотой: молекулярные связи между бифидобактериями и олигосахаридами молока. Trends Microbiol. 2011; 18: 298–307. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Оздал Т., Села Д.А., Сяо Дж. И др. Взаимодействие между полифенолами и микробиотой кишечника и влияние на биодоступность. Питательные вещества. 2016; 8: 78. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Клаассен CD, Юэ Цуй JY.Обзор: механизмы того, как кишечная микробиота влияет на действие лекарств и желчных кислот. Утилизация наркотиков. 2015; 43: 1505–21. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Spanogiannopoulos P, Bess EN, Carmody RN, et al. Фармацевты-микробиологи внутри нас: метагеномный взгляд на метаболизм ксенобиотиков. Nat Rev Microbiol. 2016; 14: 273–87. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Bron PA, Kleerebezem M, Brummer RJ, et al. Могут ли пробиотики модулировать болезнь человека, влияя на барьерную функцию кишечника? Br J Nutr.2017; 117: 93–107. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Marlicz W, Yung DE, Skonieczna-ydecka K, et al. От клинических неопределенностей до точной медицины: растущая роль кишечного барьера и микробиома в функциональных заболеваниях тонкой кишки. Эксперт Рев Гастроэнтерол Гепатол. 2017; 11: 961–78. [PubMed] [Google Scholar] 15. Клаус С.П., Гийу Х., Эллеро-Симатос С. Микробиота кишечника: главный игрок в токсичности загрязнителей окружающей среды? NPJ Biofilms Microbiomes. 2017; 3: 17001. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16.Махана Д., Трент С., Захари Д., Курц З. и др. Нарушение антибиотиками микробиома кишечника мышей усиливает ожирение, инсулинорезистентность и заболевания печени, связанные с диетой с высоким содержанием жиров. Genome Med. 2016; 8: 48. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Leszczyszyn JJ, Radomski M, Leszczyszyn AM. Трансплантация кишечной микробиоты — современный уровень знаний. Reumatologia. 2016; 54: 24–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Циммер Дж., Ланге Б., Фрик Дж. С. и др. Вегетарианская или вегетарианская диета существенно изменяет фекальную микробиоту толстой кишки человека.Eur J Clin Nutr. 2011; 66: 53–6. [PubMed] [Google Scholar] 21. Коэт Р.А., Ван З., Левисон Б.С. и др. Метаболизм L-карнитина, питательного вещества красного мяса, микробиоты кишечника способствует развитию атеросклероза. Nat Med. 2013; 19: 576–85. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Bonder MJ, Tigchelaar EF, Cai X и др. Влияние краткосрочной безглютеновой диеты на микробиом кишечника человека. Genome Med. 2016; 8:45. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Дель Кьерико Ф., Вернокки П., Даллапиккола Б. и др.Средиземноморская диета и здоровье: влияние продуктов питания на микробиоту кишечника и контроль заболеваний. Int J Mol Sci. 2014; 15: 11678–99. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Джернберг С., Лёфмарк С., Эдлунд С. и др. Долгосрочное воздействие антибиотиков на микробиоту кишечника человека. Микробиология. 2010; 156: 3216–23. [PubMed] [Google Scholar] 26. Шуберт А., Синани Х., Schloss PD. Вызванные антибиотиками изменения микробиоты кишечника мышей и последующие эффекты на устойчивость к колонизации против Clostridium difficile.MBio. 2015; 6: e00974–15. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Перес-Кобас А.Е., Артачо А., Кнехт Х. и др. Дифференциальное влияние антибактериальной терапии на структуру и функцию микробиоты кишечника человека. PLoS One. 2013; 8: e80201. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Нг К., Феррейра Дж, Хиггинботтом С. и др. Высвобожденные микробиотой сахара хозяина способствуют распространению кишечных патогенов после приема антибиотиков. Природа. 2013; 502: 96–99. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Хуанг Ю.Л., Чассар С., Хаусманн М. и др.Катаболизм сиаловой кислоты вызывает воспаление кишечника и микробный дисбактериоз у мышей. Nat Commun. 2015; 6: 8141. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Чассен Б., Корен О., Гудрич Дж. К. и др. Пищевые эмульгаторы воздействуют на микробиоту кишечника мышей, вызывая колит и метаболический синдром. Природа. 2016; 519: 404–13. [PubMed] [Google Scholar] 31. Спенсер М., Гупта А., Ван Дам Л. и др. Искусственные подсластители: систематический обзор и учебник для гастроэнтерологов. J Neurogastroenterol Motil. 2016; 22: 168–80.[Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Zhang X, Zhao Y, Xu J, et al. Модуляция кишечной микробиоты берберином и метформином во время лечения ожирения у крыс, вызванного диетой с высоким содержанием жиров. Научный доклад 2015; 5: 14405. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Макфадден Р., Лармонье С., Шехаб К. и др. Роль куркумина в модуляции микробиоты толстой кишки во время профилактики колита и рака толстой кишки. Воспаление кишечника. 2015; 21: 2483–94. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Byerleya LO, Samuelson D, Blanchard E, et al.Изменения в микробном сообществе кишечника после добавления в рацион грецких орехов. J Nutr Biochem. 2017; 48: 94–102. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Сардецка И., Крогульская А., Топоровска-Ковальская Е. Влияние иммуномодулирующих факторов питания на развитие пищевой аллергии у детей. Постэп Дерматол Алергол. 2017; 34: 89–96. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Джейкобс Д.М., Годье Э., ван Дуйнховен Дж. И др. Неперевариваемые пищевые ингредиенты, микробиота толстой кишки и влияние на здоровье кишечника и иммунитет: роль метаболомики.Curr Drug Metab. 2009; 10: 41–54. [PubMed] [Google Scholar] 37. Кардона Ф., Андрес-Лакуевак С., Тюлипани С. и др. Польза полифенолов для микробиоты кишечника и их влияние на здоровье человека. J Nutr Biochem. 2013; 24: 1415–22. [PubMed] [Google Scholar]Влияние антибиотиков и пищевых компонентов на микробиоту кишечника
Prz Gastroenterol. 2018; 13 (2): 85–92.
Кафедра фармацевтической микробиологии и паразитологии, Вроцлавский медицинский университет, Вроцлав, Польша
Автор, ответственный за переписку. Адрес для корреспонденции: Рут К. Дудек-Вихер, Кафедра фармацевтической микробиологии и паразитологии, Медицинский университет Вроцлава, ул. Боровска 211, 50-556 Вроцлав, Польша. телефон: +48 606 763 589. e-mail: [email protected]Поступила в редакцию 20 ноября 2017 г .; Принято 24 апреля 2018 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0), позволяющая третьим лицам копировать и распространять материал в любых носитель или формат, а также для ремикса, преобразования и развития материала при условии, что оригинальная работа правильно процитирована и указана лицензия.
Эта статья цитируется в других статьях в PMC.Abstract
Микробиота кишечника действует как настоящий орган. Он выполняет важные метаболические функции и регулирует воспалительную реакцию, стимулируя иммунную систему. Нарушение микробного баланса кишечника (дисбактериоз) связывают с серьезными заболеваниями человека и воспалительными заболеваниями. Симбиотические взаимодействия между резидентными микроорганизмами и желудочно-кишечным трактом значительно способствуют поддержанию гомеостаза кишечника.В настоящем обзоре обобщены наши знания о влиянии различных антибиотиков, вызывающих такие долгосрочные последствия, как снижение микробного разнообразия, модуляция соотношения Bacteroidetes / Firmicutes , избыточный рост Clostridium difficile и увеличение распространения условно-патогенных микроорганизмов Salmonella typhimurium , Escherichia spp. И Klebsiella spp. Кроме того, пищевые добавки, такие как эмульгаторы и искусственные подсластители, которые предназначены для снижения риска ожирения и диабета, могут фактически увеличить риск заболеваний из-за микробных изменений.С другой стороны, диетические компоненты, такие как полифенолы, омега-3 кислоты или куркумин, могут положительно влиять на состав микробиоты кишечника.
Ключевые слова: микробиота, антибиотики, диета
Введение
Микробиом человека содержит в десять раз больше клеток, чем остальная часть человеческого тела. В последние годы микробиота кишечника вызывает повышенный интерес в научном сообществе. Бактериальная колонизация кишечника имеет решающее значение для нормального развития многих функциональных аспектов.Нарушения микробиоты кишечника связаны со многими распространенными заболеваниями, такими как аллергии, метаболические заболевания, включая ожирение и диабет, сердечно-сосудистые заболевания [1], воспалительные заболевания кишечника (ВЗК) [2], синдром раздраженного кишечника (СРК) [3], нейродегенеративные заболевания. заболевания [4], муковисцидоз [5] и камни в почках [6]. Большинство кишечных бактерий непатогены и сосуществуют с энтероцитами в симбиотических отношениях. Многие исследования показали, что микробиота кишечника играет фундаментальную роль в поддержании гомеостаза не только в кишечнике, но и во всем организме человека.Высококачественные данные Американского проекта по микробиому человека (HMP) продемонстрировали полезные функции нормальной кишечной флоры на здоровье вплоть до генетического уровня. Например, исследования выявили несколько микробных генов, которые позволяют кишечным бактериям участвовать в интенсивном пищеварительном процессе, происходящем в пищеварительном тракте человека. Хромосомно-кодируемый HMO-родственный кластер генов 1, ответственный за переваривание олигосахаридов грудного молока, является одним из наиболее изученных доказательств вышеупомянутого феномена [7].
Целью данной рукописи является обзор избранных исследований за период 2011–2017 гг., Изучающих изменения в микробиоте кишечника, вызванные антибиотиками и ингредиентами диеты, а также их влияние на здоровье человека. Критерии поиска были основаны на 33 научных статьях, найденных в таких медицинских базах данных, как PubMed, Scopus и Science Direct.
Роль здоровой микробиоты кишечника
Микробиота кишечника относится ко всей популяции микроорганизмов, колонизирующей кишечник.Он включает огромное количество бактерий, грибов, архей, вирусов и простейших. Здоровая микробиота кишечника преимущественно состоит из типов Firmicutes и Bacteroidetes , за которыми следуют Actinobacteria и Verrucomicrobia . Эти типы остаются постоянными, но в каждой части кишечника наблюдается обширное качественное и количественное разнообразие родов.
В микробиоте кишечника встречаются следующие виды: Gemella spp., Megasphaera spp., Pseudomonas spp., Prevotella spp., Streptococcus spp., Rothia spp., Veillonella spp., Clostridium spp., Porphyromonas Eubacterium spp., Ruminococcus spp., Enterobacter spp., Enterococcus spp., Lactobacillus spp., Peptostreptococcus spp., Fusobacteria spp., Lachnacteria spp., Roseburia spp., Butyrivibrio spp., Faecalibacterium spp., Proteobacteria spp. [8].
Обычно эти микробы являются комменсалами или мутуалистами и в основном способствуют метаболизму питательных веществ, в том числе посредством ферментации углеводов. Это приводит к синтезу бутирата, короткоцепочечной жирной кислоты (SCFA), которая является важным источником энергии для колоноцитов. Он известен своими противовоспалительными и противораковыми свойствами. Кишечные микроорганизмы также положительно влияют на липидный обмен.Посредством микробных протеиназ и пептидаз они усиливают метаболизм белков. Более того, они имеют решающее значение для синтеза витамина K, B 12 , биотина и конъюгированных линолевых кислот (CLA). Они превращают желчные кислоты и участвуют в расщеплении различных полифенолов [9, 10].
Способность кишечного микробиома метаболизировать лекарственные препараты оказывает огромное влияние на терапию различных заболеваний. Например, Eggerthella lenta , присутствующее в кишечной микробиоте, снижает доступность дигоксина, превращая его в восстановленный метаболит.Кроме того, микробиом может также индуцировать метаболизм лекарственных средств, таких как противораковое средство, известное как иринотекан, что способствует его токсичности, вызывая диарею, воспаление и анорексию [11]. Физическое присутствие микробиоты в желудочно-кишечном тракте (ЖКТ) предотвращает патогенную колонизацию, конкурируя за места прикрепления или источники питательных веществ, а также за счет производства антимикробных белков (АМП), таких как кателицидины, лектины С-типа и дефенсины [8, 11]. В то же время микробиота играет важную иммуномодулирующую роль.Компоненты и типы клеток иммунной системы, которые участвуют в иммуномодулирующем процессе, включают лимфоидные ткани, ассоциированные с кишечником (GALT) [12].
Кроме того, кишечная микробиота поддерживает целостность кишечного барьера и структуру желудочно-кишечного тракта за счет веществ, продуцируемых Bacteroides thetaiotaomicron, Lactobacillus rhamnosus GG и Akkermansia muciniphila . Барьер кишечника состоит из эпителия, иммунных клеток и кишечных бактерий.Он выполняет защитную функцию от токсинов и болезнетворных микроорганизмов из внешней среды. Он участвует в пищеварении, всасывании питательных веществ, жидкостей и электролитов из пищи и ферментации клетчатки до соединений, которыми питаются кишечные бактерии. Кроме того, кишечный барьер секретирует антитела и участвует в передаче сигналов другим клеткам и органам. Микробиота кишечника способствует структурному развитию слизистой оболочки кишечника и может также модулировать паттерны гликозилирования слизистой оболочки, которые являются местами прикрепления микробов как на клеточной поверхности, так и на субклеточном уровне [8, 13, 14].
В литературе указывается, что кишечные микробы обладают большой способностью метаболизировать 430 загрязнителей окружающей среды. Более того, бактериально-зависимый метаболизм загрязнителей модулирует токсичность для хозяина. И наоборот, загрязнители окружающей среды, как было показано, изменяют состав и метаболическую активность желудочно-кишечных бактерий. Физиологические последствия этих изменений до сих пор не изучены [15]. В настоящее время хорошо известно, что здоровая флора кишечника в значительной степени отвечает за общее состояние здоровья хозяина.Существует множество доказательств того, что изменения состава микробиоты (дисбиоз) и оптимальных функций, вызванные антибиотиками, диетическими ингредиентами и факторами образа жизни, связаны с различными метаболическими и иммунными заболеваниями и увеличением патогенных популяций [1–6, 16–23]. . Однако многие исследования также показали положительный эффект некоторых питательных веществ, которые оказывают сильное влияние на развитие правильно функционирующей микробиоты.
Изменение, связанное с антибиотиками
В настоящее время есть существенные доказательства того, что состав микробиоты кишечника может колебаться в ответ на внешние факторы, такие как антибиотики.
Panda и др. . исследовали фекальную микробиоту 21 пациента после 7-дневного лечения общепринятыми группами антибиотиков: фторхинолонами и β-лактамами. Обе группы значительно снизили микробное разнообразие на 25% и сократили основную филогенетическую микробиоту с 29 до 12 таксонов. Однако на уровне филума эти антибиотики увеличивали соотношение Bacteroidetes / Firmicutes . На уровне видов было обнаружено, что оба типа антибиотиков увеличивают долю нескольких неизвестных таксонов, принадлежащих к роду Bacteroides , грамотрицательной группе бактерий.Кроме того, β-лактамы увеличивали среднюю микробную нагрузку в два раза. Изгнание микроорганизмов, чувствительных к этой группе антибиотиков, дает возможность устойчивым штаммам разрастаться и доминировать в нише [24].
Другое исследование было посвящено долгосрочным последствиям применения антибиотиков для состава, экологии и устойчивости микробиоты кишечника человека. Некоторые антибиотики особенно активны против анаэробных бактерий, которые доминируют и играют важную роль в кишечной микробиоте человека.Одним из примеров является клиндамицин, антибиотик относительно широкого спектра действия, который в первую очередь нацелен на анаэробные бактерии. Клиндамицин продемонстрировал большое негативное влияние на кишечную микробиоту, о чем свидетельствует снижение устойчивости к колонизации патогенами, что приводит к высокому риску псевдомембранозного колита из-за чрезмерного роста Clostridium difficile . К дополнительным эффектам, вызываемым клиндамицином, на кишечную флору относятся гастрит и диарея. Нарушения нормальной функции кишечника могут вызывать такие симптомы, как вздутие живота и боли в кишечнике [25].
Группа исследователей из Мичиганского университета проверила 7 антибиотиков из шести классов на модели животных с целью дифференцированного изменения микробиоты и оценки их устойчивости к колонизации C. difficile . Они наблюдали высокий уровень колонизации C. difficile у мышей, получавших цефоперазон, метронидазол и стрептомицин. Наибольшие различия в уровнях колонизации C. difficile были отмечены у мышей, получавших ампициллин.Ни одна из мышей, получавших ципрофлоксацин, не была колонизирована. Только одна из шести мышей, получавших ванкомицин, была колонизирована, предположительно из-за остаточного ванкомицина, подавляющего рост C. difficile . В целом, эти нарушения антибиотиков обеспечивали разные уровни колонизации C. difficile , что привело к гипотезе о том, что полученные сообщества различались по своему составу [26].
Другое исследование на модели человека дало результаты анализа кишечной микробиоты четырех пациентов.У каждого пациента была собственная исходная микробиота, и, таким образом, был индивидуальный ответ на лечение антибиотиками с колебаниями бактериального разнообразия и состава как для общей, так и для активной микробиоты кишечника. Эти результаты подчеркивают важность исходной микробной структуры в формировании изменений микробиоты во время лечения. В группе пациентов трое получали бактерицидный антибиотик, т.е. моксифлоксацин, цефазолин и ампициллин / сульбактам или амоксициллин, а один — бактериостатической комбинацией пенициллина G и клиндамицина.У пациента, получавшего моксифлоксацин, уменьшилось количество родов Faecalibacterium и Bacteroides . Однако в первые дни лечения другие таксоны, продуцирующие бутират, такие как Roseburia и Lachnospiraceae incertae sedis и потребляющие h3 бактерии Blautia, Collinsella и Bifidobacterium , присутствовали в качестве активной микробиоты, получая источники энергии. для колоноцитов хозяина. В случае пациента, получавшего комбинацию пенициллина G и клиндамицина, было отмечено снижение в активной микробиоте родов Bacteroides и Blautia .У пациента, получавшего цефазолин и ампициллин / сульбактам, наблюдалось значительное увеличение родов Parabacteroides и Bacteroides . Кроме того, использование этих антибиотиков вызывает оппортунистические инфекции, вызываемые Escherichia spp. или Klebsiella spp. Во время лечения четвертого пациента амоксициллином такие роды, как Escherichia или Klebsiella, были почти уничтожены, тогда как таксоны Bacteroides, Blautia и Faecalibacterium оказались менее восприимчивыми к лечению.Обращает на себя внимание тот факт, что этот бактериальный профиль с Bacteroides , Blautia и Faecalibacterium после антибиотического стресса был обнаружен в случае бактерицидных агентов, но не в случае использования бактериостатических противомикробных препаратов [27].
Было установлено, что биохимический профиль изменений, связанных с антибиотиками, также влияет на флору кишечника. Обработанный антибиотиками микробиом высвобождает такие углеводы слизистой оболочки, как фукоза и сиаловая кислота. Повышенный уровень этих веществ способствует распространению условно-патогенных микроорганизмов Salmonella typhimurium и C.difficile в кишечнике. Enterohaemorrhagic Escherichia coli также имеет доступ к фукозе или сиаловой кислоте, высвобождаемой микробиотой кишечника из муцинов [28, 29].
Для исследования взаимосвязи воздействия антибиотиков с нарушениями микробиома на мышиной модели стимуляции роста использовали модель на животных. Мыши получали субтерапевтическую терапию антибиотиками (STAT) и получали диету с высоким содержанием жиров (HFD). Чтобы охарактеризовать изменения микробиоты, вызванные STAT, была проанализирована область V4 гена 16S рРНК, полученная из собранных образцов фекалий.Изучая метаболические функции и функции печени и сравнивая их с контрольной группой мышей, получавших только HFD, было обнаружено, что этот режим способствует инсулинорезистентности и стеатозу печени. Исследование предоставляет новую информацию о взаимосвязи между антибактериальной терапией и метаболизмом, а также патогенезом ожирения [16].
В многочисленных исследованиях были определены взаимодействия между сложными популяциями кишечных микробов и иммунной системой млекопитающих (грызунов) и то, как эта связь нарушается при введении антибиотиков [7, 8, 15, 17, 24, 27].Лечение амоксициллином по существу уничтожает тонкую кишку и снижает плотность анаэробных и аэробных бактерий в толстой кишке. Изменения микробиоты, вызванные амоксициллином, снижают экспрессию генов MHC класса I и II в Lactobacillus spp. в тонком и толстом кишечнике снижают экспрессию АМФ в проксимальном отделе кишечника и увеличивают экспрессию протеазы тучных клеток в дистальном отделе тонкой кишки. Лечение мышей метронидазолом, неомицином и ванкомицином снижает экспрессию других важных иммунных факторов.Это усиливает устойчивую к ванкомицину Enterococcus (VRE) колонизацию кишечного тракта. Изменения микробиоты после лечения антибиотиками также влияют на иммунный ответ на вирусную инфекцию. Неомицин снижает экспрессию двух про-цитокинов, ухудшая реакцию против вирусов гриппа. Другое исследование показало, что лечение антибиотиками усиливает иммунный ответ против вируса опухоли молочной железы мышей (MMTV). Некоторые бактерии обладают способностью модулировать воспалительные процессы.Введение антибиотиков может изменить популяции кишечных комменсальных бактерий и, как следствие, изменить иммунную защиту, что в некоторых случаях приведет к пагубным последствиям для здоровья. Вирусные и бактериальные инфекции или аллергии могут быть вызваны изменениями микробиоты, вызванными антибиотиками [17].
Как описано выше, антибиотики могут оказывать негативное влияние на микробиоту, иммунитет и здоровье. Однако избежать приема антибиотиков часто невозможно, потому что многие инфекции можно победить только с помощью лечения антибиотиками.По этой причине необходимо протестировать новые стратегии, чтобы противодействовать негативному влиянию антибиотиков на микробиоту и иммунные реакции. Чтобы уменьшить неблагоприятные изменения микробиоты кишечника человека, вызванные терапией антибиотиками, в настоящее время широко используются коммерческие пробиотики. В основном такие продукты содержат такие штаммы, как Lactobacillus spp., Bifidobacterium spp. а также пребиотики, такие как фруктоолигосахариды. Также рекомендуется увеличить потребление традиционных ферментированных овощей и молочных продуктов.Трансплантация фекальной микробиоты становится все более эффективной и безопасной у пациентов с рецидивирующей инфекцией Clostridium difficile , воспалительным заболеванием кишечника, ожирением и метаболическим синдромом, вероятно, из-за восстановления нарушенного микробиома [18, 19].
Влияние пищевых ингредиентов
Микробиом человека различается в зависимости от культуры и географического региона. Кроме того, он не является постоянным в течение жизни, а скорее изменяется с возрастом.Диета является особенно важным фактором в определении состава микробиоты кишечника. Таким образом, веганы, вегетарианцы и всеядные имеют разные микробиомы. Общее количество Bacteroides spp., Bifidobacterium spp., Escherichia coli и Enterobacteriaceae spp. были значительно ниже в веганских образцах, чем в контроле. Напротив, всего биоваров E. coli, видов, Klebsiella spp., Enterobacter spp ., Другие Enterobacteriaceae, Enterococcus spp., Lactobacillus spp., Citrobacter spp. и Clostridium spp. были похожи. Общее количество микробов между группами не различалось. Кроме того, испытуемые, соблюдающие веганскую или вегетарианскую диету, показали значительно более низкий pH стула, чем контрольная группа, а pH стула и количество E. coli и Enterobacteriaceae значительно коррелировали во всех подгруппах. Соблюдение строгой веганской или вегетарианской диеты приводит к значительному сдвигу в микробиоте, в то время как общее количество клеток остается неизменным.Диета на основе животных увеличивала количество устойчивых к желчи микроорганизмов, включая Alistipes, Bilophila и Bacteroides , тогда как она снижала уровни Firmicutes , которые метаболизируют полисахариды пищевых растений [1, 20]. Более того, кишечная микробиота всеядных животных производит значительно больше триметиламин-N-оксида (ТМАО) из холина и L-карнитина, присутствующих в яйцах и красном мясе, чем кишечная микробиота веганов или вегетарианцев, благодаря механизму, зависящему от микробиоты.Повышенный уровень ТМАО повышает риск атеросклероза. Таким образом, кишечная микробиота может участвовать в хорошо установленной связи между повышенным потреблением красного мяса или яиц и возникновением сердечно-сосудистых заболеваний [21].
Было продемонстрировано, что даже кратковременное изменение диеты может изменить структуру микробного сообщества. Безглютеновая диета (БГД) является наиболее распространенной специальной диетой во всем мире. Был сделан вывод, что 13 недель GFD оказали значительное влияние на разнообразие микробиома между контрольной и исследуемой группами пациентов, а также наблюдались большие различия в активности путей.Более того, увеличилось количество E. coli и Enterobacteriaceae , включая условно-патогенные микроорганизмы [22].
Западная диета (с высоким содержанием животного жира и белка и низким содержанием клетчатки) приводит к уменьшению общего количества бактерий и полезных Bifidobacterium и Eubacterium , а также к увеличению производства канцерогенных нитрозаминов и воспалений. Средиземноморская диета (с высоким содержанием клетчатки и антиоксидантов и низким содержанием красного мяса) связана с повышенным уровнем фекальных короткоцепочечных жирных кислот (SCFA), Bifidobacteria, Lactobacilli, Eubacteria, Bacteroides и Prevotella [23].
Основным средством защиты кишечника от микробиоты является многослойная структура слизи, покрывающая поверхность кишечника, что позволяет держать подавляющее большинство кишечных бактерий на безопасном расстоянии от эпителиальных клеток, выстилающих кишечник. Таким образом, эмульгаторы, подобные детергентам, которые нарушают взаимодействие слизи с бактериями, могут способствовать развитию заболеваний, связанных с воспалением кишечника. Чассен и его коллеги, используя модель на животных, продемонстрировали, что эмульгаторы карбоксиметилцеллюлоза и полисорбат-80, обычно используемые в обработанной пище, изменяют уровень короткоцепочечных жирных кислот в кале, включая снижение уровня бутирата.Они также изменили уровень желчной кислоты, что влияет на состав микробиоты. В том же исследовании было высказано предположение, что вызванные эмульгатором изменения микробиоты играют роль в развитии воспаления и метаболических изменений, которым способствуют эти пищевые добавки [30].
Также было продемонстрировано, что искусственные подсластители, такие как сахарин, сукралоза, аспартам и ацесульфам К, изменяют микробные сообщества кишечника, что приводит к непереносимости глюкозы как у мышей, так и у людей. Чтобы проверить, приводят ли изменения микробного состава, вызванные потреблением некалорийных искусственных подсластителей (НАС), к непереносимости глюкозы, кишечную микробиоту мышей, получавших НАС, или контрольных мышей переносили на стерильных мышей, которых содержали в асептических условиях. , что делает их желудочно-кишечный тракт полностью стерильным.Результаты показали, что потребление NAS напрямую изменяет микробный состав и метаболизм, что приводит к важным последующим метаболическим эффектам. Та же группа ученых обнаружила корреляцию между потреблением NAS и изменением микробиома кишечника у людей. В своем исследовании 172 случайно выбранных человека из когорты показали микробные изменения кишечника, характеризующиеся увеличением типов энтеробактерий , дельтапротеобактерий и актинобактерий . Что касается воздействия на микробиом животных, было обнаружено, что общее количество анаэробов в микробиоте кишечника крыс значительно снизилось у тех, кто получал сукралозу плюс мальтодекстрин.При самой низкой дозе общее количество анаэробов снизилось примерно на 50% по сравнению с контролем. Bifidobacterium, Lactobacillus и Bacteroides также были значительно снижены при самой низкой дозе. Одновременно повышенная секреция инкретина наблюдалась при сочетании сукралозы с глюкозой. В результате наблюдалось снижение подвижности желудочно-кишечного тракта [31].
Недавно было показано, что два клинически эффективных препарата для лечения диабета — метформин и берберин — оказывают свое действие, модулируя микробиоту кишечника, и могут способствовать благотворному воздействию на хозяина.Было продемонстрировано, что они аналогичным образом изменили общую структуру кишечной микробиоты у крыс. Оба препарата показали обратное действие на структурные изменения микробиоты кишечника, вызванные диетой с высоким содержанием жиров. Разнообразие кишечной микробиоты было значительно сокращено при лечении берберином и метформином. Оба препарата уменьшили 60 из 134 операционных таксономических единиц. Напротив, бактерии, продуцирующие короткоцепочечные жирные кислоты (SCFA) — Allobaculum, Bacteroides, Blautia, Butyricicoccus и Phascolarctobacterium — были заметно увеличены.Хотя и берберин, и метформин увеличивали количество бактерий, продуцирующих SCFA, и снижали микробное разнообразие кишечника, метформин делал это в меньшей степени. Избирательное обогащение SCFA-продуцирующих бактерий и уменьшение разнообразия кишечных микробов с помощью обоих препаратов могут быть общими механизмами улучшения здоровья желудочно-кишечного тракта и могут опосредовать их благотворное влияние на хозяина, особенно при метаболических и сердечно-сосудистых заболеваниях [32].
Куркумин является наиболее активным компонентом измельченного корневища растения Curcuma longa , обладающего противовоспалительными, антиоксидантными и антипролиферативными свойствами.Было обнаружено, что куркумин оказывает существенное влияние на микробиоту кишечника. Куркумин увеличивает количество бактерий у мышей. Кроме того, он предотвращал возрастное снижение альфа-разнообразия, увеличивал относительную численность порядка Lactobacillales и уменьшал численность порядка Coriobacteriales . Поддержание более разнообразной микробной экологии толстой кишки коррелирует с положительным влиянием куркумина на онкогенез [33].
Данные указывают на связь между поступлением омега-3 в кровоток и составом микробиома, что предполагает потенциальное использование добавок омега-3 для улучшения состава микробиома.Грецкие орехи богаты омега-3 жирными кислотами, фитохимическими веществами и антиоксидантами, что делает их уникальными по сравнению с другими продуктами. Потребление грецких орехов было связано с пользой для здоровья, включая снижение риска сердечных заболеваний и рака. Один из потенциальных механизмов, с помощью которого грецкие орехи могут принести пользу для здоровья, — это изменение микробиома кишечника. Исследование Byerleya et al . выявили изменения в микробных сообществах кишечника, которые происходят после включения грецких орехов в рацион крыс.Образцы кишечника были собраны из нисходящей ободочной кишки, ДНК была выделена, и гипервариабельная область V3 – V4 гена 16S рРНК была глубоко секвенирована на Illumina MiSeq для характеристики микробиоты кишечника. Животные, потребляющие грецкие орехи, показали значительно большее видовое разнообразие. Грецкие орехи увеличили численность Firmicutes и уменьшили численность Bacteroidetes . Он также обогатил микробиоту бактериями пробиотического типа, включая Lactobacillus, Ruminococcaceae и Roseburia , при этом значительно уменьшив количество бактерий Bacteroides и Anaerotruncus [34, 35].
Примечательно, что микробиом человека может быть изменен микробными метаболитами неперевариваемых пищевых ингредиентов. В частности, «неперевариваемые» пищевые углеводы, включая полисахариды, олигосахариды, лигнин и связанный с ними растительный материал, являются предпочтительным источником энергии для микробиоты толстой кишки. В настоящее время исследователи изучают влияние микробных метаболитов полифенолов на здоровье эпителиальных клеток слизистой оболочки, кишечника и иммунной системы. Полифенолы известны своей антиоксидантной способностью, а также противовоспалительной и антипролиферативной активностью.В толстой кишке они подвергаются обширной биоконверсии и метаболизму кишечной микробиотой. Они деконъюгированы бактериальными гликозидазами, глюкуронидазами и сульфатазами и далее ферментируются до широкого спектра низкомолекулярных фенольных кислот. Таким образом, микробиота кишечника играет ключевую роль в биодоступности полифенолов и, как было показано, модулирует их укрепляющую здоровье активность посредством преобразования в более активные производные. Соединения, полученные в результате микробного метаболизма проантоцианидинов и полифенолов, обладают противовоспалительными свойствами.Эти микробные метаболиты могут быть среди терапевтических агентов нового поколения для лечения иммуно-воспалительных заболеваний, а также для ослабления воспалительной реакции на бактериальные антигены, что может иметь последствия для хронических воспалительных или аутоиммунных заболеваний, таких как воспалительное заболевание кишечника.
Однако, хотя широкий спектр полезных для здоровья свойств пищевых полифенолов был широко исследован, их влияние на модуляцию экологии кишечника и микробиоту полифенолов с двусторонним взаимодействием все еще плохо изучено.Исследования in vitro на животных и людях свидетельствуют о том, что определенные дозы выбранных полифенолов могут изменять микробный состав кишечника, и хотя некоторые группы бактерий могут быть подавлены, другие могут процветать в доступной нише экосистемы. Фенольные соединения изменяют микробиоту кишечника и, следовательно, изменяют баланс Bacteroides / Firmicutes . Например, мономеры флаван-3-ола, такие как (-) эпикатехин и (+) катехин, могут быть способны влиять на бактериальную популяцию толстого кишечника даже в присутствии других питательных веществ, таких как углеводы и белки.Было обнаружено, что (+) катехин значительно ингибировал рост Clostridium histolyticum и усиливал рост E. coli и членов группы Clostridium coccoides – Eubacterium rectale , в то время как рост Bifidobacterium и Lactobacillus spp. . остались относительно незатронутыми. Также было задокументировано, что богатый проантоцианидином экстракт виноградных косточек, даваемый здоровым взрослым в течение 2 недель, был способен значительно увеличить количество Bifidobacteria .Исследование с участием человека показало, что потребление полифенолов красного вина значительно увеличило количество Enterococcus, Prevotella, Bacteroides, Bifidobacterium, Bacteroides uniformis, Eggerthella lenta и Blautia coccoides – E. rectale при количестве Lactobacillus spp. без изменений [36, 37].
Резюме
Микробы, обитающие в желудочно-кишечном тракте человека, составляют динамическое сообщество, которое меняется на протяжении всей жизни человека, а также под действием диеты и лечебных средств.Краткое изложение положительного и отрицательного воздействия антибиотиков и пищевых добавок на микробиоту и его клиническое значение представлено ниже в разделе.
Таблица I
Сводная информация о влиянии антибиотиков и пищевых соединений на микробиоту кишечника
| Фактор | Изменение | Клиническая значимость |
|---|---|---|
| Фторхинолоны и снижение разнообразия β-лактамов | [24] , уменьшилось количество таксонов, изменилось соотношение Bacteroidetes / Firmicutes , увеличилась средняя микробная нагрузка [24] | Систематическое использование антибиотиков может изменить микробиоту в пользу устойчивых бактериальных штаммов в долгосрочной перспективе [24] |
| Клиндамицин [ 25] | Пониженная резистентность к колонизации патогенами [25] | Высокий риск псевдомембранозного колита, вызванного Разрастание Clostridium difficile , гастритом и диареей, вздутием живота и кишечной болью [25] |
| Моксактифлоксацин, амфазолин, цефазолин , амоксициллин, пенициллин G / клиндамицин [27] | Качественный и кв. антититативные изменения в родах [27] | Повышенный риск оппортунистических инфекций, вызываемых Escherichia spp.или Klebsiella spp. [27] |
| Лечение антибиотиками [17, 28, 29] | Фукоза, сиаловая кислота, выделенная из муцинов [28, 29]. Изменение кишечных комменсальных бактерий вызывает модификацию иммунной защиты [17] | Распространение условно-патогенных микроорганизмов Salmonella typhimurium, C. difficile и E. coli [28, 29]. Продвижение аллергии и вирусных инфекций [17] |
| Холин (яйца), L-карнитин (красное мясо) [21] | Повышенный уровень ТМАО [21] | Повышенный риск атеросклероза [21] |
| Western диета [23] | Уменьшение общего количества бактерий и полезных Bifidobacterium и Eubacterium [23] | Повышенное производство канцерогенных нитрозаминов и воспаление [23] |
| Эмульгаторы: карбоксиметилцеллюлоза и полисорбат-80 [30] | Пониженный уровень бутирата, измененный уровень желчной кислоты [30] | Повышенный риск воспаления и метаболических изменений [30] |
| Искусственные подсластители [31] | Увеличение Enterobacteriaceae, Deltaproteobacteria, и Actinobacteria phylum .Снижение содержания Bifidobacterium, Lactobacillus, и Bacteroides, увеличение секреции инкретина [31] | Непереносимость глюкозы, снижение подвижности и висцеральная гиперчувствительность [31] |
| Метформин и берберин [32] | Структурные изменения микробиоты кишечника значительное снижение разнообразия кишечной микробиоты, увеличение количества бактерий, продуцирующих короткоцепочечные жирные кислоты (SCFA) [32] | Профилактика метаболических заболеваний, эффект против ожирения [32] |
| Куркумин [33] | Увеличение бактериального богатства, увеличилось количество Lactobacillales, и уменьшилось Coriobacteriales [33] | Благоприятное влияние на онкогенез [33] |
| Грецкие орехи, омега-3 жирные кислоты [34, 35] | Большее видовое разнообразие, обогатило микробиоту пробиотиками. тип бактерий [34, 35] | Сниженный риск сердечных заболеваний и рака [34, 35] |
| Полифенолы a и проантоцианидины [36, 37] | Стимуляция роста полезных бактерий и ингибирование патогенных бактерий, оказывающих пребиотикоподобные эффекты, полезные соединения из их микробного метаболизма [36, 37] | Управление иммуновоспалительными заболеваниями, хроническими воспалительными аутоиммунные заболевания, такие как воспалительные заболевания кишечника [36, 37] |
Таким образом, существует множество доказательств того, что микробиота кишечника является основным, все еще недооцененным элементом, который следует рассматривать как важный фактор, влияющий на здоровье человека.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
1. Thomas S, Izard J, Walsh E, et al. Микробиом хозяина регулирует и поддерживает здоровье человека: основа и перспектива для немикробиологов. Cancer Res. 2017; 77: 1783–812. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Матияши М., Мештрович Т., Перич М. и др. Регулирование состава и метаболической активности кишечной микробиоты у пациентов с ВЗК. Int J Mol Sci. 2016; 17: 578.[Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Диструтти Э., Мональди Л., Риччи П. и др. Синдром раздраженного кишечника 2016: глобальный взгляд на роль микробиоты кишечника в синдроме раздраженного кишечника: новые терапевтические стратегии. Мир Дж. Гастроэнтерол. 2016; 22: 2219–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Форсайт П., Кунце В. Голоса изнутри: кишечные микробы и ЦНС. Cell Mol Life Sci. 2013; 70: 55–69. [PubMed] [Google Scholar] 6. Кауфман Д., Келли Дж., Курхан Г. и др. Oxalobacter formigenes может снизить риск образования камней в почках из оксалата кальция.J Am Soc Nephrol. 2008; 19: 1197–203. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Села Д.А., Миллс Д. Уход за нашей микробиотой: молекулярные связи между бифидобактериями и олигосахаридами молока. Trends Microbiol. 2011; 18: 298–307. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Оздал Т., Села Д.А., Сяо Дж. И др. Взаимодействие между полифенолами и микробиотой кишечника и влияние на биодоступность. Питательные вещества. 2016; 8: 78. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Клаассен CD, Юэ Цуй JY.Обзор: механизмы того, как кишечная микробиота влияет на действие лекарств и желчных кислот. Утилизация наркотиков. 2015; 43: 1505–21. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Spanogiannopoulos P, Bess EN, Carmody RN, et al. Фармацевты-микробиологи внутри нас: метагеномный взгляд на метаболизм ксенобиотиков. Nat Rev Microbiol. 2016; 14: 273–87. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Bron PA, Kleerebezem M, Brummer RJ, et al. Могут ли пробиотики модулировать болезнь человека, влияя на барьерную функцию кишечника? Br J Nutr.2017; 117: 93–107. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Marlicz W, Yung DE, Skonieczna-ydecka K, et al. От клинических неопределенностей до точной медицины: растущая роль кишечного барьера и микробиома в функциональных заболеваниях тонкой кишки. Эксперт Рев Гастроэнтерол Гепатол. 2017; 11: 961–78. [PubMed] [Google Scholar] 15. Клаус С.П., Гийу Х., Эллеро-Симатос С. Микробиота кишечника: главный игрок в токсичности загрязнителей окружающей среды? NPJ Biofilms Microbiomes. 2017; 3: 17001. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16.Махана Д., Трент С., Захари Д., Курц З. и др. Нарушение антибиотиками микробиома кишечника мышей усиливает ожирение, инсулинорезистентность и заболевания печени, связанные с диетой с высоким содержанием жиров. Genome Med. 2016; 8: 48. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Leszczyszyn JJ, Radomski M, Leszczyszyn AM. Трансплантация кишечной микробиоты — современный уровень знаний. Reumatologia. 2016; 54: 24–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Циммер Дж., Ланге Б., Фрик Дж. С. и др. Вегетарианская или вегетарианская диета существенно изменяет фекальную микробиоту толстой кишки человека.Eur J Clin Nutr. 2011; 66: 53–6. [PubMed] [Google Scholar] 21. Коэт Р.А., Ван З., Левисон Б.С. и др. Метаболизм L-карнитина, питательного вещества красного мяса, микробиоты кишечника способствует развитию атеросклероза. Nat Med. 2013; 19: 576–85. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Bonder MJ, Tigchelaar EF, Cai X и др. Влияние краткосрочной безглютеновой диеты на микробиом кишечника человека. Genome Med. 2016; 8:45. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Дель Кьерико Ф., Вернокки П., Даллапиккола Б. и др.Средиземноморская диета и здоровье: влияние продуктов питания на микробиоту кишечника и контроль заболеваний. Int J Mol Sci. 2014; 15: 11678–99. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Джернберг С., Лёфмарк С., Эдлунд С. и др. Долгосрочное воздействие антибиотиков на микробиоту кишечника человека. Микробиология. 2010; 156: 3216–23. [PubMed] [Google Scholar] 26. Шуберт А., Синани Х., Schloss PD. Вызванные антибиотиками изменения микробиоты кишечника мышей и последующие эффекты на устойчивость к колонизации против Clostridium difficile.MBio. 2015; 6: e00974–15. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Перес-Кобас А.Е., Артачо А., Кнехт Х. и др. Дифференциальное влияние антибактериальной терапии на структуру и функцию микробиоты кишечника человека. PLoS One. 2013; 8: e80201. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Нг К., Феррейра Дж, Хиггинботтом С. и др. Высвобожденные микробиотой сахара хозяина способствуют распространению кишечных патогенов после приема антибиотиков. Природа. 2013; 502: 96–99. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Хуанг Ю.Л., Чассар С., Хаусманн М. и др.Катаболизм сиаловой кислоты вызывает воспаление кишечника и микробный дисбактериоз у мышей. Nat Commun. 2015; 6: 8141. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Чассен Б., Корен О., Гудрич Дж. К. и др. Пищевые эмульгаторы воздействуют на микробиоту кишечника мышей, вызывая колит и метаболический синдром. Природа. 2016; 519: 404–13. [PubMed] [Google Scholar] 31. Спенсер М., Гупта А., Ван Дам Л. и др. Искусственные подсластители: систематический обзор и учебник для гастроэнтерологов. J Neurogastroenterol Motil. 2016; 22: 168–80.[Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Zhang X, Zhao Y, Xu J, et al. Модуляция кишечной микробиоты берберином и метформином во время лечения ожирения у крыс, вызванного диетой с высоким содержанием жиров. Научный доклад 2015; 5: 14405. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Макфадден Р., Лармонье С., Шехаб К. и др. Роль куркумина в модуляции микробиоты толстой кишки во время профилактики колита и рака толстой кишки. Воспаление кишечника. 2015; 21: 2483–94. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Byerleya LO, Samuelson D, Blanchard E, et al.Изменения в микробном сообществе кишечника после добавления в рацион грецких орехов. J Nutr Biochem. 2017; 48: 94–102. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Сардецка И., Крогульская А., Топоровска-Ковальская Е. Влияние иммуномодулирующих факторов питания на развитие пищевой аллергии у детей. Постэп Дерматол Алергол. 2017; 34: 89–96. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Джейкобс Д.М., Годье Э., ван Дуйнховен Дж. И др. Неперевариваемые пищевые ингредиенты, микробиота толстой кишки и влияние на здоровье кишечника и иммунитет: роль метаболомики.Curr Drug Metab. 2009; 10: 41–54. [PubMed] [Google Scholar] 37. Кардона Ф., Андрес-Лакуевак С., Тюлипани С. и др. Польза полифенолов для микробиоты кишечника и их влияние на здоровье человека. J Nutr Biochem. 2013; 24: 1415–22. [PubMed] [Google Scholar]Восстановление после антибиотиков и не только
- Флора кишечника — это микроорганизмы, которые выстилают пищеварительный тракт, помогают переваривать пищу и играют важную роль во всем, от иммунной системы до вашего веса.
- Антибиотики, сахар и даже стресс могут нарушить баланс кишечной флоры и серьезно повлиять на здоровье пищеварительной системы.
- Небольшие шаги, такие как прием определенных штаммов пробиотиков, употребление пребиотических продуктов и сокращение потребления сахара, могут помочь восстановить здоровую флору кишечника как можно скорее.
Вы чувствуете, что ваше пищеварение не в порядке. Может быть, вам нужно пройти курс антибиотиков, вы чувствуете газообразование после еды или пережили дополнительный стресс и перешли на жирную пищу и успокаивающие сладости (эй, вы же человек). Теперь вы задаетесь вопросом, как восстановить здоровую флору кишечника. Хорошие новости: вы можете предпринять шаги, чтобы поддержать здоровье пищеварительной системы и сбалансировать микробиом кишечника.Продолжайте читать, чтобы узнать, как это сделать.
Что такое кишечная флора?
В вашей пищеварительной системе обитает целый мир микроорганизмов. Эта коллекция микроорганизмов — ваша кишечная флора, также известная как кишечная микробиота — сложная экосистема, состоящая примерно из 300-500 видов бактерий. Это почти в 10 раз больше клеток в организме человека. [1]
Наши знания о взаимодействии между здоровьем кишечника и общим здоровьем все еще находятся на начальной стадии.Мы знаем, что колонии полезных бактерий помогают вам переваривать и усваивать пищу, бороться с микробами, вызывающими заболевание, и даже вырабатывать большую часть серотонина, который помогает поддерживать хорошее настроение. [2] [3] [4]
Наука продолжает открывать способы, которыми кишечные бактерии напрямую связаны с вашим здоровьем. Мы знаем, что наличие сбалансированных популяций полезных кишечных бактерий и «плохих» бактерий — это нормально, а здоровый кишечник способен держать плохих парней под контролем.Но исследователи только сейчас начинают понимать, что происходит, когда другие факторы, такие как антибиотики, диета и стресс, склоняют чашу весов в неверном направлении.
Связано: Получите хорошее ощущение кишечника с помощью Bulletproof-детоксикации и добавок для здоровья кишечника
Как различные факторы образа жизни влияют на флору кишечника
Вот один из отличительных признаков здорового кишечника: процветающая популяция полезных микробов и их разнообразное сочетание. Эти хорошие парни поддерживают общее здоровье человека, но они также предотвращают распространение вредных микробов, то есть вредных бактерий, которые могут способствовать воспалению и изменению вашего веса.
Что это значит для вас? Будьте внимательны, когда имеете дело с факторами, которые могут повлиять на ваши здоровые бактерии. Некоторые факторы, такие как возраст и болезнь, мы не контролируем. Но вы можете предпринять позитивные шаги и с другими факторами, такими как то, что вы едите после приема антибиотиков, количество сахара в вашем рационе и то, как вы справляетесь со стрессом. Ниже мы подробно рассмотрим некоторые из них, а также общие советы по восстановлению микрофлоры кишечника. Как всегда, поддерживайте открытое общение со своим врачом.
Антибиотики атакуют все кишечные бактерии (даже самые полезные)
Антибиотики нацелены на всех бактерий — как хороших, так и плохих.Вы можете предпринять определенные действия, чтобы заменить полезные бактерии, пока вы принимаете антибиотики, и помочь восстановить их баланс после окончания курса.
В свое время врачи думали, что здоровое тело — это стерильное тело, и что наша иммунная система постоянно борется с микробами, с которыми мы контактируем. После изобретения антибиотиков были спасены миллионы жизней, поскольку люди были защищены от бактериальных инфекций.
Теперь медицинское сообщество понимает, что в вашем кишечнике обитает целый мир полезных организмов, и пока мы поддерживаем их баланс, мы будем оставаться здоровыми.К сожалению, это означает, что антибиотики представляют собой одну из самых больших угроз для здоровья кишечника.
Антибиотики убивают бактерии, вызывающие инфекцию, но они также убивают полезные кишечные бактерии и разнообразие микробов, которые вы хотите взрастить. В лучшем случае у вас могут быть газы и диарея в течение нескольких дней. В худшем случае это может стать настолько плохим, что баланс вашего микробиома изменится, и вы можете столкнуться с такими проблемами, как нарушение всасывания, изменения в пищеварении, разрастание кандида (дрожжей) и даже изменения в вашем психическом здоровье.
Конечно, есть время и место для антибиотиков. При агрессивных инфекциях, хирургических вмешательствах и других случаях они необходимы вам, и нам повезло, что у нас есть доступ к лекарствам. Также лучше иметь несколько профилактических мер в заднем кармане, чтобы поддерживать здоровье кишечника, пока вы принимаете антибиотики. Таким образом, вы сможете быстрее восстановить равновесие, когда закончите.
Диета, стресс и плохой сон влияют на здоровье пищеварительной системы
Вы — то, что вы едите, по крайней мере, когда речь идет о кишечной флоре.Алкоголь и продукты с высокой степенью обработки могут негативно повлиять на здоровье кишечника, но мы собираемся сосредоточиться на одном из основных игроков: сахаре.
Диета с высоким содержанием сахара может накормить вредные бактерии в кишечнике, создавая оптимальную среду для процветания не очень хороших микробов. Это потому, что высокое потребление сахара, кажется, меняет баланс бактерий в кишечнике, увеличивая популяцию микробов, которые способствуют воспалению и проницаемости кишечника (или «дырявому кишечнику»). [5]
Переход на искусственные подсластители ничем не лучше — исследования на грызунах показывают, что сахарин, сукралоза и аспартам вызывают изменения в микробиоте кишечника и способствуют дисбактериозу кишечника или дисбалансу микроорганизмов. [6]
А как насчет стресса и сна? Вот короткое и длинное:
- Стресс и здоровье кишечника : Психический стресс — от работы до новостей до семейной жизни — может мешать общению между кишечником и мозгом, также известным как ось кишечник-мозг. Эта пропущенная связь способствует появлению таких симптомов, как тошнота, вздутие живота и даже здоровью кишечных бактерий.
- Сон и здоровье кишечника : Недосыпание (или хронический некачественный сон) может негативно изменить соотношение бактерий в кишечнике, увеличивая риск инсулинорезистентности, повышенной проницаемости кишечника и даже тяги к сахару.
Связанные: Избавьтесь от сахарной привычки с помощью этих пуленепробиваемых альтернативных подсластителей
Как восстановить здоровую флору кишечника
Вам не нужно сидеть сложа руки и просто ждать, пока ваше тело восстановится. Читайте дальше, чтобы узнать, как восстановить микрофлору кишечника, чтобы вы пришли в норму и почувствовали себя лучше с микробиомом кишечника Rockstar.
Принимайте пробиотики для восстановления микрофлоры кишечника
Пробиотики — это полезные кишечные бактерии, которые, среди прочего, поддерживают здоровое пищеварение, производят питательные вещества и избавляются от токсинов и патогенов.Диета, богатая пробиотиками (такими как кефир, квашеная капуста, чайный гриб и кимчи), может помочь хорошим микробам заселиться в кишечнике и сдержать появление недружелюбных. Хед-ап:
Наличие гистамина в ферментированных продуктах означает, что некоторые варианты, такие как мисо и обычный йогурт, подходят не всем. Добавки с пробиотиками — суперэффективные способы включить эти полезные бактерии в свой рацион.
Вот и легкая победа: Bulletproof Unflavored Gut Health Collagen Protein покрывает все ваши основы.Он содержит пробиотики, а также пребиотики акации (подробнее о пребиотиках ниже), глицин и цинк карнозин для здоровой слизистой оболочки кишечника.
Что нужно знать о пробиотиках и антибиотиках
Каждая доза антибиотиков уничтожает большую часть бактерий по всему вашему телу, включая хороших парней. После этого хорошие и недружелюбные микробы медленно восстанавливаются, и, если все идет хорошо, они возвращаются в равновесие. Но на это нужно время, и они не всегда колонизируют в гармонии.
Чтобы один штамм кишечной флоры не захватил верх, принимайте пробиотические добавки во время приема антибиотиков. [7] [8] Дружественные пробиотические бактерии могут не колонизировать кишечник, но они все равно могут помочь вам пройти курс лечения антибиотиками.
Если вы правильно рассчитаете дозировку пробиотиков, полезные бактерии, которые только что проходят, смогут делать свою работу и держать плохих парней под контролем. Некоторые из них даже выживут и смогут поддерживать баланс, пока следующая доза антибиотиков не уничтожит их.
- Время и тип имеют решающее значение. : Убедитесь, что вы принимаете пробиотики как минимум за два часа до или после приема антибиотиков. Кроме того, если вы чувствительны к пробиотикам, избегайте штаммов, которые могут генерировать гистамины, таких как Lactobacillus casei , Lactobacillus reuteri и Lactobacillus bulgaricus . [9] [10] Вместо этого выберите Lactobacillus plantarum, Bifdocaterium lactis, Bifdocaterium infantis и Bifidobacterium longum .Эти штаммы снижают уровень гистамина, уменьшают воспаление и улучшают пищеварение. [11] [12]
- Возьмите S. boulardii : S. boulardii — это полезные дрожжи, а не бактерии, поэтому антибиотики их не трогают. В нескольких исследованиях исследователи обнаружили, что S. boulardii предотвращает диарею, связанную с антибиотиками (AAD), когда они вводят его с антибиотиками. [13] [14] [15] [16]
Принимайте пребиотики для кормления полезных бактерий
Пробиотики необходимы, но для того, чтобы хорошие бактерии процветали, их нужно есть.Вот почему вам нужны пребиотики в своем рационе. Пребиотики — это соединения, которые питают полезные кишечные бактерии. Сытые, дружелюбные бактерии населяют слизистую оболочку кишечника, помогая поддерживать здоровый биом. Это помогает восстановить и сохранить целостность слизистой оболочки кишечника. [17]
Пребиотики можно получить из корня цикория, артишоков, лука-порея, цельного зерна и продуктов с высоким содержанием резистентного крахмала — типа крахмала, который сопротивляется перевариванию. [18] Он ферментирует пищеварительный тракт и питает полезные бактерии в кишечнике. [19] Источники устойчивого крахмала включают необжаренные кешью, сырые зеленые бананы, сырую муку из подорожника и сырой картофельный крахмал. У некоторых людей это может вызвать расстройство пищеварения, поэтому начните медленно и увеличьте количество до нескольких столовых ложек.
Вот простой способ включить пребиотики в свой рацион: принимать добавки с пребиотиками. Bulletproof InnerFuel Prebiotic содержит разнообразную смесь пребиотиков растительного происхождения для поддержки здорового пищеварения. Он легко смешивается с горячими или холодными жидкостями, поэтому его можно легко добавлять в кофе, смузи и коктейли ежедневно.
Уменьшите потребление сахара
Диета с высоким содержанием рафинированного сахара, искусственных подсластителей и даже натурального сахара (включая фрукты!) Может нарушить баланс кишечной флоры, поэтому вам следует ограничить потребление сахара, особенно в отношении антибиотиков.
Без бактерий, которые могут держать их в страхе, у грибов есть возможность занять себя во время курса антибиотиков. Многие проблемы, которые возникают после приема антибиотиков, такие как диарея и инфекции на юге, можно приписать чрезмерному росту грибков, особенно дрожжей.Одним из проблемных штаммов грибка является Candida albicans, который особенно склонен к сбою после приема антибиотиков. [20]
Кандида питается сахаром и простыми углеводами (например, хлебом и макаронами), которые организм быстро превращает в сахар. Кандида будет процветать, если она будет получать сахар из пищи, которую вы едите, а бактерии не будут сопротивляться. [21] Чтобы он не взял верх, сводите потребление сахара и углеводов к минимуму. Они не уйдут очень далеко, если у них не будет достаточного количества пищи.
Выпейте костный бульон или примите пептиды коллагена
Бактерии, выстилающие пищеварительный тракт, защищают мембраны, удерживающие внутреннее содержимое кишечника на своем месте. По мере того, как они изнашиваются, у грибов появляется шанс заселиться на их месте. Когда грибы растут, они выпускают гифы, тонкие нитевидные корни, которые впиваются в стенки кишечника. По сути, они прокалывают дыры в кишечнике, что позволяет частично переваренным частицам пищи выходить за пределы пищеварительного тракта и вызывать проблемы.
Итак, что вы можете сделать? Убедитесь, что вы едите продукты, поддерживающие крепкую соединительную ткань, например костный бульон и продукты, богатые коллагеном. Коллаген — это белок, который скрепляет ваши мембраны, и прием пептидов коллагена даст вашим клеткам все необходимые им аминокислоты, когда придет время сделать стенки кишечника более прочными и эластичными
Вы не можете производить коллаген без витамина С, поэтому рекомендуется увеличить потребление витамина С при добавлении гидролизованного коллагена.(Вот почему Bulletproof Collagen Protein также содержит витамин С.)
Связано: ваше полное руководство по пептидам коллагена
Ешьте много овощей
Когда большая часть бактерий уничтожается, они медленно восстанавливаются. Как и в случае с любым населением, конкурирующим за ресурсы, это своего рода гонка за повторное заселение. Пока это происходит, вы хотите кормить хороших парней и морить голодом плохих парней.
Нарезка сахара унесет вас далеко. Пока вы закрываете бар на вечеринке с дрожжами, почему бы не подать желанным гостям цельную еду? Кишечные микробы, которые помогают переваривать и усваивать пищу, любят овощи.Это имеет смысл, потому что они едят ту часть овощей, которую человек не расщепляет, и превращают эти порции в питательные вещества, которые иначе вы бы не получили.
Положите в тарелку цельные продукты, которые едят дружелюбные микробы, и еще больше хороших парней заселят ваш кишечник. В частности, ищите ярко окрашенные овощи (например, темную листовую зелень и яркие крестоцветные овощи). Помимо полезной для кишечника клетчатки, эти овощи являются источниками полифенолов — растительных антиоксидантов, которые могут помочь увеличить популяцию полезных кишечных бактерий. [22] Поговорим о большом побочном эффекте.
А чтобы получить дополнительную порцию полифенолов в вашем рационе, попробуйте Bulletproof Polyphenomenal — ежедневную антиоксидантную добавку, которая содержит разнообразную смесь полифенолов из ягод и растений, таких как гранат, черника и зеленый чай.
Читать далее: 6 научно обоснованных добавок для здоровья кишечника
Присоединяйтесь к пуленепробиваемой революции
Подпишитесь, чтобы получить ранний доступ к продажам, запускам продуктов, последним новостям Bulletproof и многому другому!
Эта статья была обновлена.
Состав кишечных бактерий почти восстанавливается после приема антибиотиков — ScienceDaily
Триллионы бактерий в кишечнике человека влияют на наше здоровье множеством способов, включая влияние на иммунные функции и обмен веществ. Считается, что богатая и разнообразная микробиота кишечника способствует укреплению здоровья, предоставляя человеку-хозяину множество возможностей для предотвращения хронических заболеваний. Напротив, плохое разнообразие экосистемы кишечника является характерной чертой хронических заболеваний, включая ожирение, диабет, астму и воспалительные заболевания кишечника.
Из-за того, что антибиотики в целом убивают бактерии, было высказано предположение, что повторное использование антибиотиков лишает людей богатой кишечной бактериальной среды и, таким образом, приводит к неблагоприятным последствиям для здоровья.
Международная группа исследователей во главе с Копенгагенским университетом и Центром диабета Стено в Копенгагене сообщает, что когда 3 антибиотика давали молодым здоровым мужчинам в течение 4 дней, это привело к почти полному уничтожению кишечных бактерий с последующим постепенным восстановлением большинства бактерий. видов в течение шести месяцев.
Однако по прошествии шести месяцев участникам исследования по-прежнему не хватало девяти общих полезных бактерий, и несколько новых потенциально нежелательных бактерий колонизировали кишечник. Результаты опубликованы сегодня в журнале « Nature Microbiology ».
«Мы показываем, что кишечное бактериальное сообщество здоровых взрослых людей устойчиво и способно восстанавливаться после кратковременного одновременного воздействия трех разных антибиотиков. Однако наши результаты также предполагают, что воздействие антибиотиков широкого спектра действия может уменьшить разнообразие кишечной бактериальной экосистемы. .Антибиотики могут быть благом для сохранения здоровья человека, но их следует использовать только на основании четких доказательств бактериальной причины инфекции », — объясняет руководитель исследования профессор Олуф Педерсен, Центр фундаментальных метаболических исследований Novo Nordisk.
Отсутствуют ли полезные кишечные микробы в западном мире из-за чрезмерного использования антибиотиков?
Исследование представляет собой четырехдневное вмешательство с использованием трех так называемых «крайних мер» антибиотиков широкого спектра действия у 12 взрослых здоровых мужчин. Метод с коктейлем из трех антибиотиков был разработан, чтобы имитировать реальное лечение в отделениях интенсивной терапии.
Кишечник — это резервуар сотен различных видов бактерий с генами устойчивости к антибиотикам. Это было подтверждено в исследовании, поскольку эти бактериальные гены были инициирующей силой, которая привела к пополнению запасов бактерий в кишечнике.
«В этом случае хорошо, что мы можем регенерировать нашу кишечную микробиоту, которая важна для нашего общего здоровья. Однако проблема связана с потенциально необратимой потерей полезных бактерий после многократного воздействия антибиотиков в течение нашей жизни.Есть свидетельства того, что западное население имеет значительно меньшее разнообразие кишечной микробиоты, чем коренные жители, живущие в определенных частях Африки и Амазонки. Одним из возможных объяснений этого может быть широкое использование антибиотиков при лечении инфекционных заболеваний », — говорит Олуф Педерсен.
История Источник:
Материалы предоставлены Копенгагенским университетом Факультет здравоохранения и медицинских наук . Примечание. Содержимое можно редактировать по стилю и длине.
Понимание влияния воздействия антибиотиков на микробиом человека | Геномная медицина
Линч С.В., Педерсен О. Микробиом кишечника человека в здоровье и болезнях. N Engl J Med. 2016; 375 (24): 2369–79.
CAS PubMed Google Scholar
Кау А.Л., Ахерн П.П., Гриффин Н.В., Гудман А.Л., Гордон Дж. Питание человека, микробиом кишечника и иммунная система. Природа. 2011. 474 (7351): 327–36.
CAS PubMed PubMed Central Google Scholar
Дэвид Л.А., Морис К.Ф., Кармоди Р.Н., Гутенберг Д.Б., Баттон Дж. Э., Вулф Б. Э. и др. Диета быстро и воспроизводимо изменяет микробиом кишечника человека. Природа. 2014. 505 (7484): 559–63.
CAS PubMed Google Scholar
Sharon G, Sampson TR, Geschwind DH, Mazmanian SK. Центральная нервная система и микробиом кишечника.Клетка. 2016; 167 (4): 915–32.
CAS PubMed PubMed Central Google Scholar
Стокгольм Дж., Блазер М.Дж., Торсен Дж., Расмуссен М.А., Вааге Дж., Виндинг Р.К. и др. Созревание микробиома кишечника и риск астмы в детстве. Nat Commun. 2018; 9 (1): 141.
PubMed PubMed Central Google Scholar
Вальдес А.М., Вальтер Дж., Сигал Э., Спектор Т.Д.Роль микробиоты кишечника в питании и здоровье. BMJ. 2018; 361: к2179.
PubMed PubMed Central Google Scholar
Ллойд-Прайс Дж., Арзе С., Анантакришнан А.Н., Ширмер М., Авила-Пачеко Дж., Пун Т.В. и др. Многокомпонентность микробной экосистемы кишечника при воспалительных заболеваниях кишечника. Природа. 2019; 569 (7758): 655–62.
CAS PubMed PubMed Central Google Scholar
Tasnim N, Abulizi N, Pither J, Hart MM, Gibson DL. Связь микробной экосистемы кишечника с окружающей средой: зависит ли здоровье кишечника от того, где мы живем? Front Microbiol. 2017; 8: 1935.
PubMed PubMed Central Google Scholar
Сталдер Т., Пресс М.О., Салливан С., Лячко И., Топ Е.М. Связывание резистома и плазмидома с микробиомом. ISME J. 2019; 13 (10): 2437–46.
PubMed PubMed Central Google Scholar
Крофтс Т.С., Гаспаррини А.Дж., Дантас Г. Подходы нового поколения к пониманию и борьбе с резистомом к антибиотикам. Обзоры природы микробиологии. 2017; 15 (7): nrmicro.2017.28.
Truong DT, Franzosa EA, Tickle TL, Scholz M, Weingart G, Pasolli E, et al. MetaPhlAn2 для расширенного метагеномного таксономического профилирования. Нат методы. 2015; 12 (10): 902-3-3.
CAS PubMed Google Scholar
Каллахан Б.Дж., Макмерди П.Дж., Розен М.Дж., Хан А.В., Джонсон А.Дж., Холмс С.П.DADA2: вывод образца с высоким разрешением из данных ампликона Illumina. Природные методы. 2016; 13 (7): nmeth.3869.
Wood DE, Lu J, Langmead B. Улучшенный метагеномный анализ с Kraken 2. Genome Biol. 2019; 20 (1): 257.
CAS PubMed PubMed Central Google Scholar
Browne HP, Forster SC, Anonye BO, Kumar N, Neville BA, Stares MD, et al. Культивирование «некультивируемой» микробиоты человека обнаруживает новые таксоны и обширное спороношение.Природа. 2016; 533 (7604): 543–6.
CAS PubMed PubMed Central Google Scholar
Соммер МО, Чёрч Г.М., Дантас Г. Микробиом человека содержит разнообразный резервуар генов устойчивости к антибиотикам. Вирулентность. 2010. 1 (4): 299–303.
PubMed Google Scholar
Камински Дж., Гибсон М.К., Франзоза Е.А., Сегата Н., Дантас Дж., Хаттенхауэр С. Высокоспецифичное целевое функциональное профилирование микробных сообществ с помощью ShortBRED.PLoS Comput Biol. 2015; 11 (12): e1004557.
PubMed PubMed Central Google Scholar
Franzosa EA, McIver LJ, Rahnavard G, Thompson LR, Schirmer M, Weingart G, et al. Функциональное профилирование метагеномов и метатранскриптомов на уровне видов. Нат Методы 2018; 15 (11): 962-8-8.
Гибсон М.К., Форсберг К.Дж., Дантас Г. Улучшенная аннотация детерминант устойчивости к антибиотикам позволяет выявить кластер микробной резистентности по экологии.ISME J. 2015; 9 (1): 207–16.
CAS PubMed Google Scholar
Дуррант М.Г., Ли М.М., Сиранозиан Б.А., Монтгомери С.Б., Бхатт А.С. Биоинформатический анализ интегративных мобильных генетических элементов подчеркивает их роль в адаптации бактерий. Клеточный микроб-хозяин. 2020; 27 (1): 140–53 e9.
CAS PubMed Google Scholar
Сберро Х., Фремин Б.Дж., Злитни С., Эдфорс Ф., Гринфилд Н., Снайдер М.П. и др.Масштабный анализ микробиомов человека позволяет выявить тысячи мелких. Novel Genes Cell. 2019; 178 (5): 1245–59 e14.
CAS PubMed Google Scholar
Гилберт Дж. А., Блазер М. Дж., Капорасо Дж. Г., Янссон Дж. К., Линч С. В., Найт Р. Текущее понимание микробиома человека. Nat Med. 2018; 24 (4): 392–400.
CAS PubMed PubMed Central Google Scholar
Knight R, Vrbanac A, Taylor BC, Aksenov A, Callewaert C, Debelius J, et al. Лучшие практики для анализа микробиомов. Nat Rev Microbiol. 2018; 16 (7): 410.
CAS PubMed Google Scholar
Уолтер Дж., Армет А.М., Финлей Б.Б., Шанахан Ф. Установление или преувеличение причинно-следственной связи микробиома кишечника: уроки грызунов, связанных с микробиотой человека. Клетка. 2020; 180 (2): 221–32.
CAS PubMed Google Scholar
Gopalakrishnan V, Spencer CN, Nezi L, Reuben A, Andrews MC, Karpinets TV, et al. Микробиом кишечника модулирует ответ на иммунотерапию анти-PD-1 у пациентов с меланомой. Наука (Нью-Йорк, Нью-Йорк). 2018; 359 (6371): 97–103.
CAS Google Scholar
Смит М.И., Яцуненко Т., Манари М.Дж., Трехан И., Мкакося Р., Ченг Дж. И др. Микробиомы кишечника малавийских пар близнецов не соответствуют квашиоркору. Наука (Нью-Йорк, Нью-Йорк). 2013. 339 (6119): 548–54.
CAS Google Scholar
Стюарт С.Дж., Аджами, штат Нью-Джерси, О’Брайен Д.Л., Хатчинсон Д.С., Смит Д.П., Вонг М.К. и др. Временное развитие микробиома кишечника в раннем детстве по данным исследования TEDDY. Природа. 2018; 562 (7728): 583-8-8.
CAS PubMed PubMed Central Google Scholar
Бауман-Дуденхёффер А.М., Д’Суза А.В., Тарр П.И., Уорнер Б.Б., Дантас Г.Младенческая диета и прибавка в весе у матери во время беременности предсказывают раннее метаболическое созревание кишечных микробиомов. Nat Med. 2018; 24 (12): 1822-9-9.
CAS PubMed PubMed Central Google Scholar
Яссур М., Ватанен Т., Сильяндер Х., Хамалайнен А.М., Харконен Т., Риханен С.Дж. и др. Естественная история микробиома кишечника младенца и влияние лечения антибиотиками на разнообразие и стабильность бактериальных штаммов. Science Transl Med. 2016; 8 (343): 343ra81.
Google Scholar
Винсент К., Миллер М.А., Эденс Т.Дж., Мехротра С., Дьюар К., Манжес АР. Цветение и спад: динамика кишечной микробиоты в ответ на воздействие в больнице и колонизацию или инфекцию Clostridium difficile. Микробиом. 2016; 4: 12.
PubMed PubMed Central Google Scholar
D’Souza AW, Potter RF, Wallace M, Shupe A, Patel S, Sun X и др.Пространственно-временная динамика бактерий с множественной лекарственной устойчивостью на поверхностях отделений интенсивной терапии. Nat Commun. 2019; 10 (1): 4569.
PubMed PubMed Central Google Scholar
Майер Л., Прутяну М., Кун М., Целлер Г., Тельцеров А., Андерсон Е. Е. и др. Обширное влияние неантибиотических препаратов на кишечные бактерии человека. Природа. 2018; 555 (7698): 623–8.
CAS PubMed PubMed Central Google Scholar
Гаспаррини А.Дж., Ван Б., Сунь Х, Кеннеди Е.А., Эрнандес-Лейва А., Ндао И.М. и др. Устойчивые метагеномные признаки госпитализации в раннем возрасте и лечения антибиотиками в микробиоте и резистоме кишечника младенца. Nat Microbiol. 2019; 4 (12): 2285–97.
PubMed PubMed Central Google Scholar
Чу Д.М., Ма Дж., Принц А.Л., Энтони К.М., Сеферович М.Д., Аагаард К.М. Созревание структуры и функции сообщества микробиома младенца во многих участках тела и в зависимости от способа доставки.Nat Med. 2017; 23 (3): 314–26.
CAS PubMed PubMed Central Google Scholar
Lim ES, Zhou Y, Zhao G, Bauer IK, Droit L, Ndao IM, et al. Динамика вирома кишечника человека и бактериального микробиома у младенцев в раннем возрасте. Nat Med. 2015; 21 (10): 1228–34.
CAS PubMed PubMed Central Google Scholar
Яцуненко Т., Рей Ф. Э., Манари М. Дж., Трехан И., Домингес-Белло М. Г., Контрерас М. и др.Микробиом кишечника человека в зависимости от возраста и географии. Природа. 2012. 486 (7402): 222–7.
CAS PubMed PubMed Central Google Scholar
Яссур М., Джейсон Э., Хогстром Л.Дж., Артур Т.Д., Трипати С., Сильяндер Х. и др. Штаммовый анализ передачи бактерий от матери ребенку в течение первых нескольких месяцев жизни. Клеточный микроб-хозяин. 2018; 24 (1): 146-54.e4-54.e4.
Ватанен Т., Плихта Д.Р., Сомани Дж., Мунк П.К., Артур Т.Д., Холл А.Б. и др.Геномная изменчивость и штамм-специфическая функциональная адаптация микробиома кишечника человека в раннем возрасте. Nat Microbiol. 2019; 4 (3): 470–9.
CAS PubMed Google Scholar
Hill CJ, Lynch DB, Murphy K, Ulaszewska M, Jeffery IB, O’Shea CA, et al. Эволюция состава кишечной микробиоты от рождения до 24 недель в когорте INFANTMET. Микробиом. 2017; 5 (1): 4.
PubMed PubMed Central Google Scholar
Субраманиан С., Хук С., Яцуненко Т., Хак Р., Махфуз М., Алам М.А. и др. Стойкая незрелость кишечной микробиоты у голодающих детей Бангладеш. Природа. 2014; 510 (7505): 417–21.
CAS PubMed PubMed Central Google Scholar
Дэвид Л.А., Матерна А.С., Фридман Дж., Кампос-Баптиста М.И., Блэкберн М.К., Перротта А. и др. Образ жизни хозяина ежедневно влияет на микробиоту человека. Genome Biol. 2014; 15 (7): R89.
PubMed PubMed Central Google Scholar
Faith JJ, Guruge JL, Charbonneau M, Subramanian S, Seedorf H, Goodman AL, et al. Долгосрочная стабильность микробиоты кишечника человека. Наука (Нью-Йорк, Нью-Йорк). 2013; 341 (6141): 1237439.
Google Scholar
Caporaso JG, Lauber CL, Costello EK, Berg-Lyons D, Gonzalez A, Stombaugh J, et al. Движущиеся картинки микробиома человека. Genome Biol. 2011; 12 (5): R50.
PubMed PubMed Central Google Scholar
Мехта Р.С., Абу-Али Г.С., Дрю Д.А., Ллойд-Прайс Дж., Субраманиан А., Лочхед П. и др. Стабильность фекального микробиома человека в когорте взрослых мужчин. Nat Microbiol. 2018; 3 (3): 347-55-55.
CAS PubMed PubMed Central Google Scholar
McLaren MR, Willis AD, Callahan BJ. Последовательная и корректируемая систематическая ошибка в экспериментах по метагеномному секвенированию. eLife. 2019; 8e46923.
Шмидер Р., Эдвардс Р.Быстрая идентификация и устранение контаминации последовательностей из наборов геномных и метагеномных данных. PLoS One. 2011; 6 (3): e17288.
CAS PubMed PubMed Central Google Scholar
Дэвис Н.М., Проктор Д.М., Холмс С.П., Релман Д.А., Каллахан Б.Дж. Простая статистическая идентификация и удаление загрязняющих последовательностей в данных маркера-гена и метагеномики. Микробиом. 2018; 6 (1): 226.
PubMed PubMed Central Google Scholar
Минич Дж. Дж., Сандерс Дж. Г., Амир А., Хамфри Дж., Гилберт Дж., Найт Р. Количественная оценка и понимание межкважинного загрязнения в исследованиях микробиома. mSystems. 2019; 4 (4): e00186–19.
Флорес Дж. Г., Капорасо Дж. Г., Хенли Дж. Б., Райдаут Дж. Р., Домогала Д., Чейз Дж. И др. Временная изменчивость — это индивидуальная особенность микробиома человека. Genome Biol. 2014; 15 (12): 531.
PubMed PubMed Central Google Scholar
Костелло Е.К., Стагаман К., Детлефсен Л., Боханнан Б.Дж., Релман Д.А. Применение экологической теории к пониманию микробиома человека. Наука (Нью-Йорк, Нью-Йорк). 2012. 336 (6086): 1255–62.
CAS Google Scholar
Ватанен Т., Франзоза Э.А., Швагер Р., Трипати С., Артур Т.Д., Вехик К. и др. Микробиом кишечника человека при диабете типа 1 с ранним началом из исследования TEDDY. Природа. 2018; 562 (7728): 589-94-94.
CAS PubMed PubMed Central Google Scholar
D’Souza AW, Moodley-Govender E, Berla B, Kelkar T., Wang B, Sun X и др. Профилактика котримоксазолом увеличивает распространенность гена устойчивости и альфа-разнообразие, но снижает бета-разнообразие в кишечном микробиоме неинфицированных младенцев, подвергшихся воздействию ВИЧ. Clin Infect Dis. 2019: ciz1186.
Парнанен К., Каркман А., Халтман Дж., Лира С., Бенгтссон-Пальме Дж., Ларссон Д. Дж. Дж. И др. Микробиота кишечника и грудного молока матери влияет на устойчивость кишечника младенцев к антибиотикам и мобильные генетические элементы. Nat Commun.2018; 9 (1): 3891.
PubMed PubMed Central Google Scholar
Nogacka A, Salazar N, Suarez M, Milani C, Arboleya S, Solis G, et al. Влияние антимикробной профилактики во время родов на микробиоту кишечника и распространенность генов устойчивости к антибиотикам у доношенных новорожденных, родившихся через естественные родовые пути. Микробиом. 2017; 5 (1): 93.
PubMed PubMed Central Google Scholar
Гибсон М.К., Ван Б., Ахмади С., Бернхэм С.-АД, Тарр П.И., Уорнер Б.Б. и др. Динамика развития микробиоты кишечника недоношенных новорожденных и резистома к антибиотикам. Природная микробиология. 2016; 1 (4): nmicrobiol201624.
Бокулич Н.А., Чанг Дж., Батталья Т., Хендерсон Н., Джей М., Ли Н. и др. Антибиотики, способ родов и диета влияют на созревание микробиома в молодом возрасте. Трансляционная медицина науки. 2016; 8 (343): 343ra82.
PubMed PubMed Central Google Scholar
Palleja A, Mikkelsen KH, Forslund SK, Kashani A, Allin KH, Nielsen T, et al. Восстановление кишечной микробиоты здоровых взрослых после воздействия антибиотиков. Nat Microbiol. 2018; 3 (11): 1255-65-65.
CAS PubMed Google Scholar
Доан Т., Хинтервирт А., Уорден Л., Арзика А.М., Малики Р., Абду А. и др. Изменение микробиома кишечника в MORDOR I: рандомизированное исследование массового распределения азитромицина. Nat Med. 2019; 25 (9): 1370–6.
CAS PubMed Google Scholar
Доан Т., Арзика А.М., Хинтервирт А., Малики Р., Чжун Л., Каммингс С. и др. Устойчивость к макролидам в MORDOR I — кластерном рандомизированном исследовании в Нигере. N Engl J Med. 2019; 380 (23): 2271–3.
PubMed PubMed Central Google Scholar
Suez J, Zmora N, Zilberman-Schapira G, Mor U, Dori-Bachash M, Bashiardes S, et al.Восстановление микробиома слизистой оболочки кишечника после приема антибиотиков нарушается пробиотиками и улучшается с помощью аутологичного FMT. Клетка. 2018; 174 (6): 1406–23 e16.
CAS PubMed Google Scholar
Шульман Дж., Диманд Р. Дж., Ли ХК, Дуэнас Г. В., Беннетт М. В., Гулд Дж. Б.. Использование антибиотиков в отделении интенсивной терапии новорожденных. Педиатрия. 2015; 135 (5): 826–33.
PubMed Google Scholar
Cantey JB, Возняк PS, Pruszynski JE, Sanchez PJ. Снижение ненужного использования антибиотиков в отделении интенсивной терапии новорожденных (SCOUT): проспективное исследование с прерывистыми временными рядами. Lancet Infect Dis. 2016; 16 (10): 1178–84.
PubMed Google Scholar
Cantey JB, Wozniak PS, Sanchez PJ. Проспективное наблюдение за использованием антибиотиков в отделении интенсивной терапии новорожденных: результаты исследования SCOUT. Pediatr Infect Dis J. 2015; 34 (3): 267–72.
PubMed Google Scholar
Шульман Дж., Профит Дж., Ли ХК, Дуэнас Дж., Беннетт М.В., Паруча Дж. И др. Варианты использования антибиотиков в неонатальном периоде. Педиатрия. 2018; 142 (3): e20180115.
Shipp KD, Chiang T, Karasick S, Quick K, Nguyen ST, Cantey JB. Проблемы рационального использования антибиотиков в отделении интенсивной терапии новорожденных. Am J Perinatol. 2016; 33 (5): 518–24.
PubMed Google Scholar
Донг Й, Шпеер CP. Поздний неонатальный сепсис: последние события. Arch Dis Child Fetal Neonatal Ed. 2015; 100 (3): F257.
PubMed Google Scholar
Брукс Б., Фирк Б.А., Миллер С.С., Шарон И., Томас Б.К., Бейкер Р. и др. Микробы в отделении интенсивной терапии новорожденных напоминают микробы, обнаруженные в кишечнике недоношенных детей. Микробиом. 2014; 2 (1): 1.
PubMed PubMed Central Google Scholar
Sommer MO, Dantas G, Church GM. Функциональная характеристика резервуара устойчивости к антибиотикам в микрофлоре человека. Наука (Нью-Йорк, Нью-Йорк). 2009. 325 (5944): 1128–31.
CAS Google Scholar
Цзя Б., Рафения А. Р., Алкок Б., Ваглехнер Н., Го П., Цанг К. К. и др. CARD 2017: расширение и модельно-ориентированное лечение всеобъемлющей базы данных по устойчивости к антибиотикам. Nucleic Acids Res. 2017; 45 (D1): D566 – d73.
CAS PubMed Google Scholar
Fouhy F, Watkins C, Hill CJ, O’Shea CA, Nagle B., Dempsey EM, et al. Перинатальные факторы влияют на микробиоту кишечника до четырех лет после рождения. Nat Commun. 2019; 10 (1): 1517.
PubMed PubMed Central Google Scholar
Стюарт С.Дж., Скит Т., Нельсон А., Фернстад С.Дж., Маррс Э.С., Перри Д.Д. и др. Микробиота и метаболом кишечника недоношенных после выписки из реанимации. Научный доклад 2015; 5: 17141.
CAS PubMed PubMed Central Google Scholar
Доусон-Хан Э.Е., Микан С., Онакпоя И., Робертс Н., Кронман М., Батлер С.К. и др. Краткосрочный курс перорального лечения антибиотиками в сравнении с длительным курсом лечения инфекций в амбулаторных условиях: обзор систематических обзоров. Fam Pract. 2017; 34 (5): 511–9.
PubMed PubMed Central Google Scholar
Льюис Дж. Д., Чен Э. З., Балдассано Р. Н., Отли А. Р., Гриффитс А. М., Ли Д. и др. Воспаление, антибиотики и диета как факторы стресса окружающей среды кишечного микробиома при болезни Крона у детей.Клеточный микроб-хозяин. 2015; 18 (4): 489–500.
CAS PubMed PubMed Central Google Scholar
Willmann M, Vehreschild M, Biehl LM, Vogel W, Dorfel D, Hamprecht A, et al. Отчетливое влияние антибиотиков на микробиом и резистом кишечника: продольное многоцентровое когортное исследование. BMC Biol. 2019; 17 (1): 76.
PubMed PubMed Central Google Scholar
Shaw LP, Bassam H, Barnes CP, Walker AS, Klein N, Balloux F. Моделирование восстановления микробиома после антибиотиков с использованием структуры ландшафта стабильности. ISME J. 2019; 13 (7): 1845–56.
CAS PubMed PubMed Central Google Scholar
Raymond F, Ouameur AA, Deraspe M, Iqbal N, Gingras H, Dridi B, et al. Исходное состояние микробиома кишечника человека определяет его изменение под действием антибиотиков. ISME J. 2016; 10 (3): 707–20.
CAS PubMed Google Scholar
Li J, Rettedal EA, van der Helm E, Ellabaan M, Panagiotou G, Sommer MOA. Лечение антибиотиками способствует разнообразию резистома кишечника человека. Геномика Протеомика Биоинформатика. 2019; 17 (1): 39–51.
CAS PubMed PubMed Central Google Scholar
Бюлоу Э., Белло Гонсалес TDJ, Фуэнтес С., де Стинхейсен Питерс ВАА, Лахти Л., Байджанов Дж. Р. и др.Сравнительный анализ микробиоты кишечника и профилей резистома у пациентов интенсивной терапии, получающих селективную дезактивацию пищеварительного тракта, и у здоровых субъектов. Микробиом. 2017; 5 (1): 88.
PubMed PubMed Central Google Scholar
Кантеле А., Лавери Т., Меро С., Вилкман К., Пакканен С.Х., Оллгрен Дж. И др. Противомикробные препараты повышают риск колонизации путешественников энтеробактериями, продуцирующими бета-лактамазы расширенного спектра действия. Клинические инфекционные болезни.2015; 60 (6): 837–46.
PubMed PubMed Central Google Scholar
Arcilla MS, van Hattem JM, Haverkate MR, Bootsma MCJ, van Genderen PJJ, Goorhuis A, et al. Импорт и распространение Enterobacteriaceae, продуцирующих бета-лактамазы расширенного спектра действия, международными путешественниками (исследование COMBAT): проспективное многоцентровое когортное исследование. Lancet Infect Dis. 2017; 17 (1): 78–85.
PubMed Google Scholar
Геверс Д., Кугатасан С., Денсон Л.А., Васкес-Баеза И., Ван Треурен В., Рен Б. и др. Микробиом, ранее не получавший лечения, при впервые возникшей болезни Крона. Клеточный микроб-хозяин. 2014; 15 (3): 382–92.
CAS PubMed PubMed Central Google Scholar
Salazar N, Valdes-Varela L, Gonzalez S, Gueimonde M, de Los Reyes-Gavilan CG. Питание и микробиом кишечника у пожилых людей. Кишечные микробы. 2017; 8 (2): 82–97.
CAS PubMed Google Scholar
Салазар Н., Арболея С., Вальдес Л., Стэнтон С., Росс П., Руис Л. и др. Микробиом кишечника человека в экстремальном возрасте. Диетическое вмешательство как способ противодействия изменениям. Фронт Жене. 2014; 5: 406.
PubMed PubMed Central Google Scholar
Клэссон М.Дж., Кьюсак С., О’Салливан О., Грин-Диниз Р., де Верд Н., Фланнери Е. и др. Состав, изменчивость и временная стабильность кишечной микробиоты пожилых людей.Proc Natl Acad Sci U S. A. 2011; 108 (Приложение 1): 4586–91.
CAS PubMed Google Scholar
Детлефсен Л., Релман Д.А. Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков. Proc Natl Acad Sci U S. A. 2011; 108 (Приложение 1): 4554–61.
CAS PubMed Google Scholar
Isaac S, Scher JU, Djukovic A, Jimenez N, Littman DR, Abramson SB, et al.Краткосрочное и долгосрочное влияние перорального ванкомицина на микробиоту кишечника человека. J Antimicrob Chemother. 2017; 72 (1): 128–36.
CAS PubMed Google Scholar
Smillie CS, Sauk J, Gevers D, Friedman J, Sung J, Youngster I, et al. Отслеживание штаммов позволяет выявить детерминанты приживления бактерий в кишечнике человека после трансплантации фекальной микробиоты. Клеточный микроб-хозяин. 2018; 23 (2): 229–40 e5–40.e5.
CAS PubMed Google Scholar
Лэнгдон А., Крук Н., Дантас Дж. Влияние антибиотиков на микробиом на протяжении всей разработки и альтернативные подходы к терапевтическому регулированию. Геномная медицина. 2016; 8 (1): 39.
PubMed PubMed Central Google Scholar
Йернберг С., Лофмарк С., Эдлунд С., Янссон Дж. К.. Долгосрочное воздействие антибиотиков на микробиоту кишечника человека. Микробиология (Рединг, Англия). 2010. 156 (Pt 11): 3216–23.
CAS Google Scholar
Round JL, Ли С.М., Ли Дж., Тран Дж., Джабри Б., Чатила Т.А. и др. Путь Toll-подобного рецептора 2 устанавливает колонизацию комменсалом человеческой микробиоты. Наука (Нью-Йорк, Нью-Йорк). 2011. 332 (6032): 974–7.
CAS Google Scholar
Tett A, Huang KD, Asnicar F, Fehlner-Peach H, Pasolli E, Karcher N, et al. Комплекс Prevotella copri состоит из четырех отдельных клад, недостаточно представленных в западных популяциях. Клеточный микроб-хозяин.2019; 26 (5): 666–79.e7.
Рудгар М., Гуд Б.Х., Гаруд Н.Р., Мартис С., Авула М., Чжоу В. и др. Секвенирование с продольным связыванием чтения показывает экологические и эволюционные реакции микробиома кишечника человека во время лечения антибиотиками. bioRxiv. 2019.
Zhao S, Lieberman TD, Poyet M, Kauffman KM, Gibbons SM, Groussin M, et al. Адаптивная эволюция микробиомов кишечника здоровых людей. Клеточный микроб-хозяин. 2019; 25 (5): 656–67 e8.
CAS PubMed PubMed Central Google Scholar
Isanaka S, Langendorf C, Berthe F, Gnegne S, Li N, Ousmane N и др. Обычное применение амоксициллина при неосложненной тяжелой острой недостаточности питания у детей. N Engl J Med. 2016; 374 (5): 444–53.
CAS PubMed Google Scholar
Кинан Дж. Д., Бейли Р. Л., Западная СК, Арзика А. М., Харт Дж., Уивер Дж. И др. Азитромицин для снижения детской смертности в странах Африки к югу от Сахары. N Engl J Med. 2018; 378 (17): 1583–92.
CAS PubMed PubMed Central Google Scholar
Trehan I, Schechtman KB, Manary MJ. Амоксициллин при тяжелой острой недостаточности питания у детей. N Engl J Med. 2016; 375 (2): 191.
PubMed Google Scholar
Богоч II, Утцингер Дж., Ло, Северная Каролина, Эндрюс Дж. Массовое применение антибактериальных препаратов для снижения детской смертности: возможности, проблемы и возможные дальнейшие шаги. PLoS Negl Trop Dis. 2019; 13 (5): e0007315.
PubMed PubMed Central Google Scholar
Маатауи Н., Лангендорф С., Берта Ф., Байджанов Дж. Р., ван Шайк В., Исанака С. и др. Повышенный риск приобретения и передачи энтеробактерий, продуцирующих БЛРС, у истощенных детей, подвергшихся воздействию амоксициллина. J Antimicrob Chemother. 2020; 75 (3): 709–17.
CAS PubMed Google Scholar
CDC. Угрозы устойчивости к антибиотикам в США. Атланта: Департамент здравоохранения и социальных служб; 2019.
Google Scholar
Woerther P-L, Angebault C, Jacquier H, Hugede H-C, Janssens A-C, Sayadi S и др. Массовое увеличение, распространение и обмен генов, кодирующих β-лактамазу расширенного спектра, среди кишечных Enterobacteriaceae у госпитализированных детей с тяжелой острой недостаточностью питания в Нигере. Clin Infect Dis. 2011; 53 (7): 677-85-85.
CAS PubMed Google Scholar
Заура Э., Брандт Б.В., Тейшейра де Маттос М.Дж., Буйс М.Дж., Касперс М.П., Рашид М.Ю. и др.Такое же воздействие, но два радикально разных ответа на антибиотики: устойчивость микробиома слюны по сравнению с долгосрочными микробными изменениями в кале. mBio. 2015; 6 (6): e01693–15.
CAS PubMed PubMed Central Google Scholar
Детлефсен Л., Хусе С., Согин М.Л., Релман Д.А. Всестороннее воздействие антибиотика на микробиоту кишечника человека, как показало глубокое секвенирование 16S рРНК. PLoS Biol. 2008; 6 (11): e280.
PubMed PubMed Central Google Scholar
Брандт Л.Дж., Арониадис О.К., Меллоу М., Канатзар А., Келли С., Парк Т. и др. Долгосрочное наблюдение после колоноскопической трансплантации фекальной микробиоты по поводу рецидива инфекции Clostridium difficile. Am J Gastroenterol. 2012. 107 (7): 1079–87.
PubMed Google Scholar
Оренштейн Р., Дубберке Э., Харди Р., Рэй А., Муллан К., Парди Д.С. и др. Безопасность и долговечность RBX2660 (суспензия микробиоты) при рецидивирующей инфекции Clostridium difficile : результаты исследования PUNCH CD.Clin Infectious Dis. 2016; 62 (5): 596–602.
Google Scholar
DeFilipp Z, Peled JU, Li S, Mahabamunuge J, Dagher Z, Slingerland AE, et al. Сторонняя трансплантация фекальной микробиоты после алло-HCT восстанавливает разнообразие микробиома. Blood Adv. 2018; 2 (7): 745–53.
CAS PubMed PubMed Central Google Scholar
Ван И, Висноски Д.Х., Хельминк Б.А., Гопалакришнан В., Чой К., DuPont HL и др.Трансплантация фекальной микробиоты при рефрактерном колите, связанном с ингибиторами иммунных контрольных точек. Nat Med. 2018; 24 (12): 1804-8-8.
CAS PubMed PubMed Central Google Scholar
Таур Y, Койт К., Шлютер Дж., Робилотти Э., Фигероа С., Гьонбалай М. и др. Восстановление микробиоты кишечника пациентов, принимающих антибиотики, путем трансплантации аутологичной фекальной микробиоты. Science Transl Med. 2018; 10 (460): eaap9489.
Hocquart M, Lagier JC, Cassir N, Saidani N, Eldin C., Kerbaj J, et al. Ранняя трансплантация фекальной микробиоты улучшает выживаемость при тяжелых инфекциях Clostridium difficile. Clin Infectious Dis. 2018; 66 (5): 645–50.
CAS Google Scholar
Hourigan SK, Ahn M, Gibson KM, Perez-Losada M, Felix G, Weidner M, et al. Пересадка кала детям с Clostridioides difficile обеспечивает устойчивое снижение устойчивости к противомикробным препаратам и потенциального бремени патогенов.Открытый форум Infectious Dis. 2019; 6 (10): ofz379.
Google Scholar
Миллан Б., Парк Х, Хотте Н., Матье О, Бургьер П., Томпкинс Т.А. и др. Трансплантаты фекальных микробов снижают уровень генов устойчивости к антибиотикам у пациентов с рецидивирующей инфекцией Clostridium difficile. Clin Infectious Dis. 2016; 62 (12): 1479–86.
CAS Google Scholar
Вудворт М.Х., Хайден М.К., Янг В.Б., Квон Дж. Х.Роль трансплантации фекальной микробиоты в уменьшении колонизации кишечника устойчивыми к антибиотикам организмами: текущая ситуация и будущие направления. Открытый форум инфекционных болезней. 2019; 6 (7): ofz288.
Dubberke ER, Mullane KM, Gerding DN, Lee CH, Louie TJ, Guthertz H, et al. Удаление устойчивых к ванкомицину Enterococcus одновременно с введением препарата на основе микробиоты, нацеленного на рецидивирующую инфекцию Clostridium difficile . Открытый форум инфекционных болезней.2016; 3 (3): ofw133.
Bulow C, Langdon A, Hink T, Wallace M, Reske KA, Patel S, et al. Влияние амоксициллина-клавуланата с последующей трансплантацией аутологичной фекальной микробиоты на структуру и метаболический потенциал фекального микробиома. мСфера. 2018; 3 (6): e00588–18.
Шварц Д. Д., Ребек О. Н., Дантас Г. Сложные взаимодействия между микробиомом и иммунотерапией рака. Критик Rev Clin Lab Sci. 2019; 56 (8): 567–85.
CAS PubMed PubMed Central Google Scholar
Хемпель С., Ньюберри С.Дж., Махер А.Р., Ван З., Майлз Дж. Н., Шанман Р. и др. Пробиотики для профилактики и лечения диареи, связанной с антибиотиками: систематический обзор и метаанализ. Джама. 2012. 307 (18): 1959–69.
CAS PubMed Google Scholar
Kabbani TA, Pallav K, Dowd SE, Villafuerte-Galvez J, Vanga RR, Castillo NE, et al. Проспективное рандомизированное контролируемое исследование влияния Saccharomyces boulardii CNCM I-745 и амоксициллина-клавуланата или их комбинации на микробиоту кишечника здоровых добровольцев.Кишечные микробы. 2017; 8 (1): 17–32.
CAS PubMed Google Scholar
Zmora N, Zilberman-Schapira G, Suez J, Mor U, Dori-Bachash M, Bashiardes S, et al. Персонализированная устойчивость к колонизации слизистой оболочки кишечника эмпирическими пробиотиками связана с уникальными особенностями хозяина и микробиома. Клетка. 2018; 174 (6): 1388–405.e21–405.e21.
ДеФилипп З., Блум П.П., Торрес Сото М., Мансур М.К., Сатер MRA, Хантли М.Х. и др.Лекарственно-резистентная бактериемия E. coli, передающаяся при трансплантации фекальной микробиоты. N Engl J Med. 2019; 381 (21): 2043–50.
PubMed Google Scholar
Администрация FaD. Информация, касающаяся дополнительных мер безопасности в отношении использования фекальной микробиоты для трансплантации — скрининг и тестирование доноров стула на организмы с множественной лекарственной устойчивостью FDA.gov2019 [обновлено 18.06.2019.
Brito IL, Alm EJ.Отслеживание штаммов в микробиоме: выводы из метагеномики и моделей.
